الکتروفورز | چیستی، انواع، اصول و عملکرد
آیا تابهحال فکر کردهاید که ذرهبینی داشته باشید که انواع مختلف مولکولهای DNA، RNA و حتی پروتئینها را از یکدیگر تفکیک کند؟ الکتروفورز، یکی از بهترین ابزارهای ما برای جداسازی و تحلیل دقیق DNA، RNA و پروتئینها است. این فناوری قدرتمند نه تنها به ما این امکان را میدهد که مولکولها را بر اساس اندازه و خواص الکتریکی آنها جدا کنیم، بلکه در تشخیص بیماریها، تحقیقات جنایی و ارزیابی وضعیت محیطزیست نیز از آن استفاده میشود. در این مقاله از مجله بیوزوم، با اصول اولیه، انواع، کاربردها، مراحل انجام و نکات کلیدی این تکنیک آشنا میشویم. با مطالعه این مطلب، درک کاملی از الکتروفورز به دست خواهید آورد و میتوانید از آن بهعنوان منبعی ارزشمند در زمینههای مختلف علمی و پژوهشی استفاده کنید.
الکتروفورز اصطلاحی است که برای توصیف حرکت ذرات در یک ژل یا مایع، درون یک میدان الکتریکی نسبتاً یکنواخت استفاده میشود. از الکتروفورز میتوان برای جداسازی مولکولها بر اساس بار، اندازه و تمایل پیوندی استفاده کرد. این تکنیک عمدتاً برای جداسازی و تحلیل بیومولکولها مانند DNA، RNA، پروتئینها، اسیدهای نوکلئیک، پلاسمیدها و قطعات این ماکرومولکولها به کار میرود. این روش برای شناسایی منبع DNA، مانند آزمایش ابویت و علم جرمشناسی نیز کاربرد زیادی دارد.
حال که به طور خلاصه با این روش آشنا شدیم باید بدانیم که این تکنیک انواع متفاوتی دارد که در ادامه به آن میپردازیم.
انواع الکتروفورز چیست؟
الکتروفورز شامل چندین تکنیک تحلیلی مرتبط است. مثالهایی از این تکنیکها عبارتند از:
الکتروفورز تمایلی (Affinity electrophoresis)
نوعی از الکتروفورز است که در آن ذرات بر اساس تشکیل کمپلکس یا تعامل بیوسپسیفیک جدا میشوند. این روش بر اساس تغییر الگوی الکتروفورتیک مولکولها است. ارتباط یک مولکول باردار با بدون بار با یکدیگر سبب ایت تغییر الگو میشود.
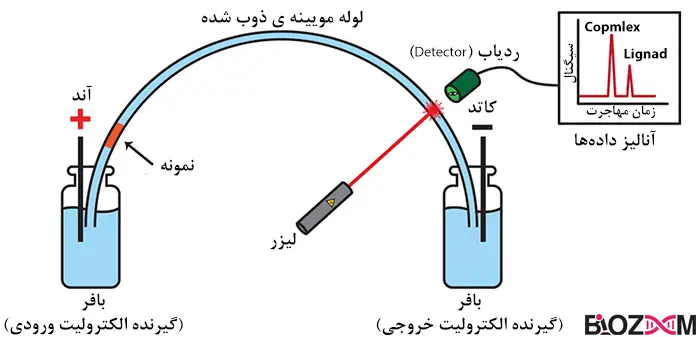
الکتروفورز مویینهای (Capillary electrophoresis)
این روش ترکیبی از الکتروفورز و کروماتوگرافی مایع است که برای جداسازی یونها عمدتاً بر اساس شعاع اتمی، بار و ویسکوزیته استفاده میشود. همانطور که از نام آن پیداست، این تکنیک معمولاً در یک لوله شیشهای از جنس سیلیس بسیار نازک با قطر زیر 1 میلیمتر انجام میشود. این روش نتایج سریع و جداسازی با وضوح بالا را ارائه میدهد.
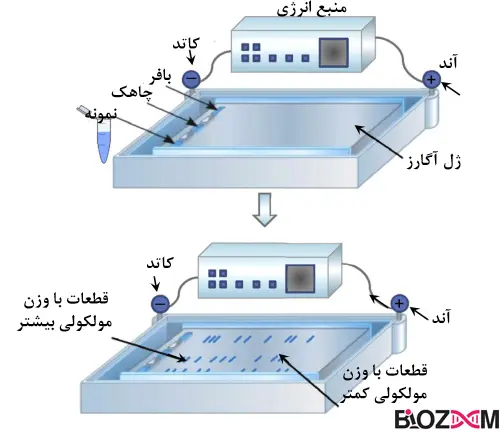
الکتروفورز ژل (Gel electrophoresis)
الکتروفورز ژل نوع گستردهای از الکتروفورز است که در آن مولکولها با حرکت در یک ژل متخلخل، بر اساس اندازه و بار تحت تأثیر میدان الکتریکی جدا میشوند. دو ماده ژلی اصلی آگارز و پلیاکریلآمید هستند. اصطلاح ژل در واقع به ماتریسی گفته میشود که مولکولها را از یکدیگر جدا میکند. این ژل ترکیبات متعددی دارد که بر اساس ترکیب مولکول هدف انتخاب میشوند. به طور کلی از دو نوع ژل آگارز و پلی آکریل آمید برای ساخت ژل استفاده میشود.
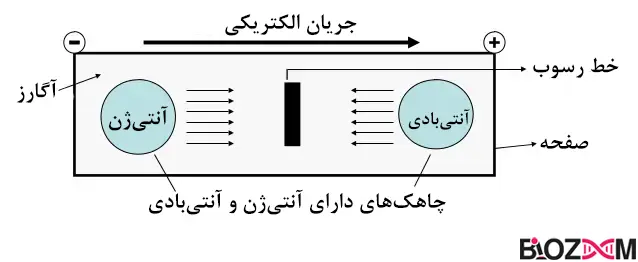
ایمونوالکتروفورز یا ایمونوفیکساسیون (Immunoelectrophoresis)
نام عمومی است که به مجموعهای از تکنیکهای الکتروفورزی داده میشود که برای شناسایی و جداسازی پروتئینها بر اساس واکنش آنها با آنتیبادیها استفاده میشوند.
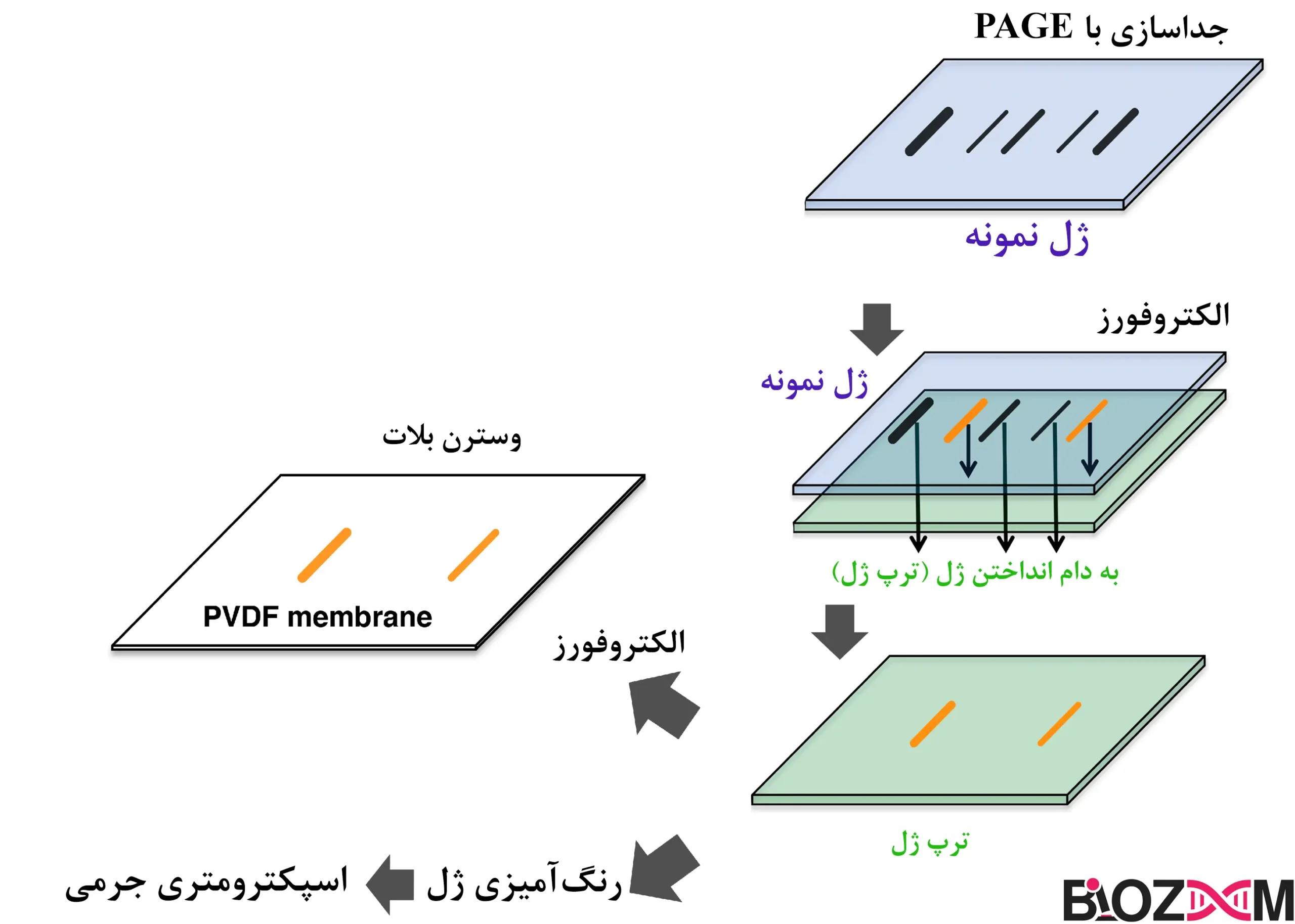
الکتروبلاتینگ (Electroblotting)
الکتروبلاتینگ تکنیکی است که برای بازیابی اسیدهای نوکلئیک یا پروتئینها پس از الکتروفورز با انتقال آنها به یک غشاء استفاده میشود. در این روش، پلیمرهای پلیوینیلیدن فلوراید (PVDF) یا نیتروسلولز معمولاً استفاده میشوند. پس از بازیابی نمونه، میتوان آن را با استفاده از رنگها یا پروبها بیشتر تحلیل کرد. وسترن بلات یک شکل از الکتروبلاتینگ است که برای شناسایی پروتئینهای خاص با استفاده از آنتیبادیهای مصنوعی استفاده میشود.
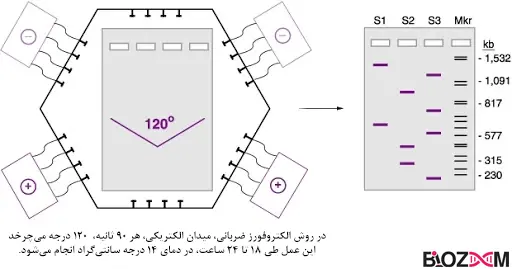
الکتروفورز ژل با میدان پالسی (Pulsed-field gel electrophoresis)
الکتروفورز با میدان پالسی یا ضربانی، برای جداسازی ماکرومولکولها، مانند DNA، با تغییر دورهای جهت میدان الکتریکی اعمال شده به یک ماتریس ژل استفاده میشود. دلیل تغییر جهت میدان الکتریکی این است که الکتروفورز ژل سنتی قادر به جداسازی کارآمد مولکولهای بسیار بزرگ نیست که تمایل دارند با هم حرکت کنند. تغییر جهت میدان الکتریکی به مولکولها جهتهای اضافی برای حرکت میدهد، بنابراین آنها مسیری برای عبور از ژل پیدا میکنند به عبارت دیگر با متناوب عمل کردن الکترودهای مثبت و منفی، مولکولهای DNA به قطعات کوچکتری تقسیم میشوند. ولتاژ معمولاً بین سه جهت تغییر میکند: یکی در امتداد محور ژل و دو تای دیگر در زاویه ۶۰ درجه به هر طرف. اگرچه این فرآیند زمان بیشتری نسبت به الکتروفورز ژل سنتی میبرد، اما در جداسازی قطعات بزرگ DNA بهتر عمل میکند.
مطلب مرتبط: دی ان ای (DNA) چیست؟ – به زبان ساده
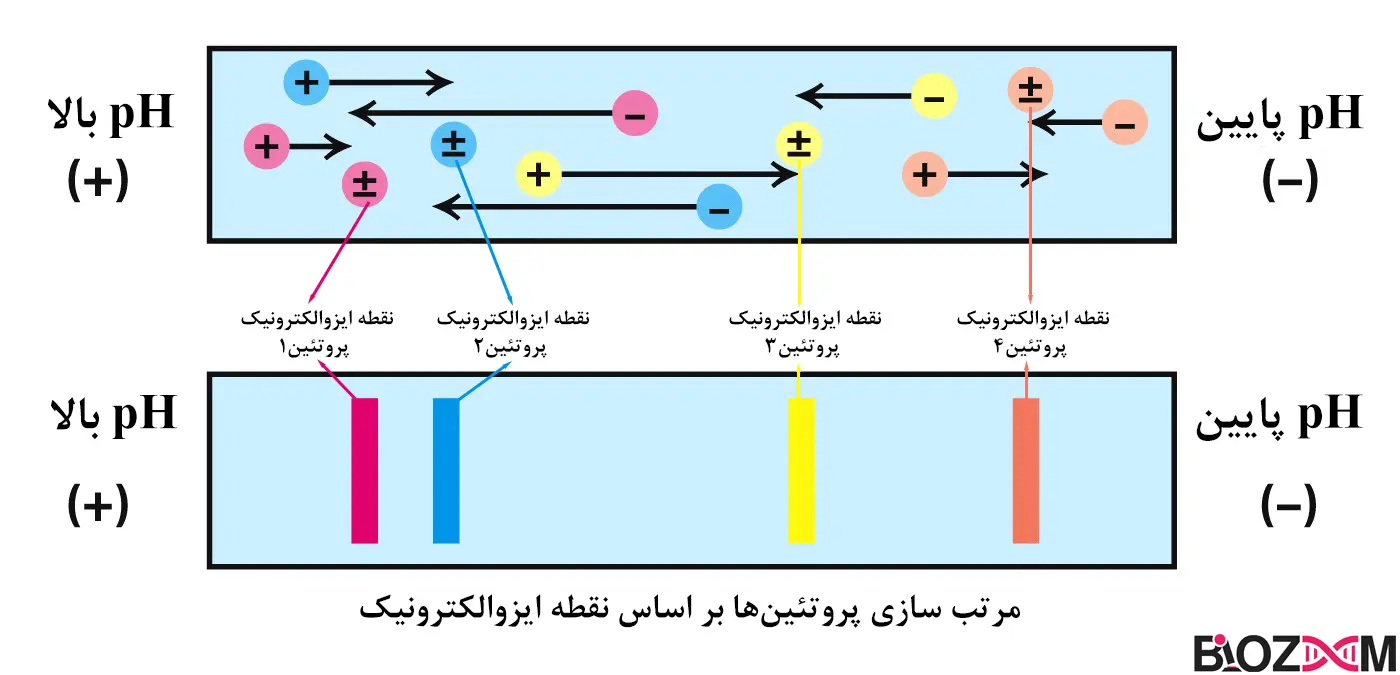
تمرکز ایزوالکتریک (Isoelectric focusing)
تمرکز ایزوالکتریک (IEF یا الکتروفوکوسینگ) نوعی از الکتروفورز است که مولکولها را بر اساس نقاط ایزوالکتریک مختلف جدا میکند. IEF بیشتر روی پروتئینها انجام میشود زیرا بار الکتریکی آنها به pH بستگی دارد. در واقع در این روش یک شیب pH در سطح ژل ایجاد میشود و با اعمال یک ولتاژ بالا، مولکولهای پروتئین راحتتر به نقطهای که بارشان صفر است حرکت میکنند.
تفاوت ژل آگارز و پلی آکریل آمید چیست؟
1.آگارز از زنجیرههای طولانی غیر انشعابدار کربوهیدارت تشکیل شده است که که اتصالات عرضی ندارد و بدون بار است و ژلی با منافذ بزرگ ایجاد میکند و پلیمر آن گروههای باردار دارد که در فرایندی جریان آب را در جهت مخالف حرکت DNA ایجاد کرده پس مانند یک نیروی اصطکاک عمل کرده و حرکت DNA را کند کرده و سبب تیرگی باند میشود اما مونومر آکریل آمید برای سیستم عصبی انسان سمی است و حالت پودری دارد پس از افرودن اب، آغازگر رادیکالهای آزاد به آن اضافه شده و پلی آکریل آمید ایجاد میشود.
2. ژلهای آگارز قدرت تفکیک کمتری برای DNA دارند در حالیکه دامنه جدایی آنها بیشتر است و قطعات DNA با اندازه 50 تا 20000 جفت باز را جدا میکند اما ژلهای پلی آکریل آمید معمولا برای پروتئینها و قطعات کوچک DNA (بین 5 تا 500 جفت باز) استفاده میشود.
3. ژل آگارز معمولا به صورت افقی و ژل پلی آکریل آمید به صورت عمودی اجرا میشود.
4. ژل آگارز سادهتر و با حرارت محلولی از بافر و پودر آگارز تهیه میشود اما ژل پلی آکریل آمید در یک واکنش پلیمریزاسیون شیمیایی تشکیل میشود.
اصول الکتروفورز چیست؟
در الکتروفورز، دو عامل اصلی سرعت حرکت یک ذره و جهت آن را کنترل میکنند. اول، بار نمونه اهمیت دارد. گونههای با بار منفی خالص به قطب مثبت میدان الکتریکی یا همان آند جذب میشوند، در حالی که گونههایی با بار مثبت خالص به انتهای منفی یا کاتد جذب میشوند. یک گونه خنثی ممکن است در صورتی که میدان قوی باشد یونیزه شود، در غیر این صورت معمولاً تحت تأثیر قرار نمیگیرد.
عامل دیگر اندازه ی ذره است. زمانیکه میدان الکتریکی اعمال میشود، یونها و مولکولهای کوچکتر میتوانند از طریق ژل یا مایع بسیار سریعتر از مولکولهای بزرگتر حرکت کنند و در نهایت مولکولهای با اندازههای متفاوت، باندهای متفاوتی روی ژل از ایجاد میکنند.
الکتروفورز چگونه انجام میشود؟
آمادهسازی ژل
ژلهای آگارز معمولاً برای مشاهده قطعات DNA استفاده میشوند. غلظت آگارز مورد استفاده برای تهیه ژل به اندازه قطعات DNA که با آنها کار میکنید بستگی دارد.
هرچه غلظت آگارز بالاتر باشد، ماتریس متراکم تر خواهد بود. قطعات کوچکتر DNA در غلظتهای بالاتر آگارز جدا میشوند در حالی که مولکولهای بزرگتر نیاز به غلظت کمتر آگارز دارند.
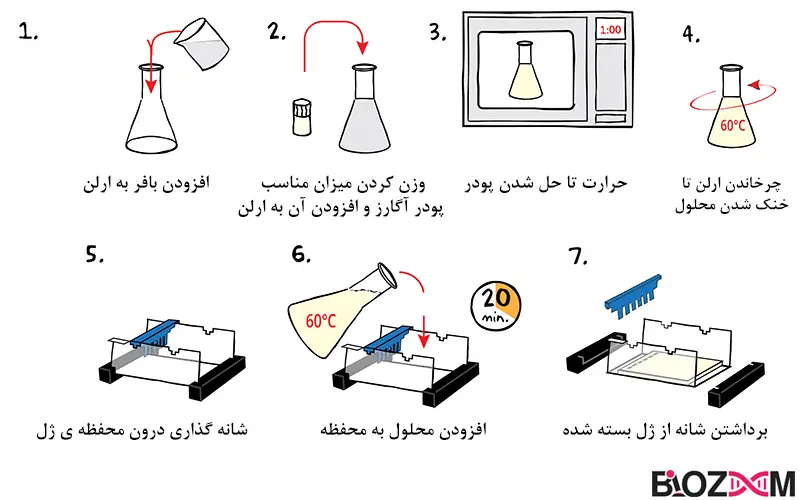
برای تهیه ژل، پودر آگارز وزن شده و با یک بافر الکتروفورز مخلوط شده و تا دمای بالا حدود 300 درجه سانتیگراد حرارت داده میشود تا تمام پودر آگارز در بافر ذوب شود، در این زمان محلول بدون رنگ و شفاف خواهد شد. ژل مذاب پس از رسیدن به دمای محیط، درون یک سینی ژل ریخته شده و یک «شانه» در یک طرف آن قرار میگیرد تا چاهکهایی برای جایگذاری نمونه ایجاد شود که در آنها نمونه ریخته میشود.
پس از سرد شدن و جامد شدن ژل (اکنون به جای شفاف کدر خواهد بود) شانه برداشته میشود. سپس ژل در یک تانک الکتروفورز قرار داده شده و بافر الکتروفورز در تانک ریخته میشود تا سطح ژل پوشانده شود. بافر جریان الکتریکی را هدایت میکند. نوع بافر استفاده شده به اندازه تقریبی قطعات DNA در نمونه بستگی دارد.
آمادهسازی DNA برای الکتروفورز
قبل از الکتروفورز، یک رنگ به نمونه DNA اضافه میشود تا ویسکوزیته نمونه افزایش یابد و از بیرون آمدن آن از چاهکها جلوگیری کند و همچنین حرکت نمونه در ژل قابل مشاهده باشد.
یک نشانگر DNA (که به عنوان استاندارد اندازه یا نردبان DNA نیز شناخته میشود) در اولین چاهک ژل بارگذاری میشود. قطعات موجود در نشانگر دارای طول مشخصی هستند و میتوانند برای تخمین اندازه قطعات در نمونهها استفاده شوند. سپس نمونههای DNA آماده شده در چاههای باقیمانده ژل پیپت میشوند. پس از انجام این کار، درپوش روی تانک الکتروفورز قرار میگیرد و مطمئن میشویم که جهتگیری ژل و الکترودهای مثبت و منفی صحیح است (ما میخواهیم DNA به سمت انتهای مثبت ژل مهاجرت کند).
جدا کردن قطعات
پس از لود نمونهها درون ژل، جریان الکتریکی اعمال میشود تا DNA با بار منفی به سمت سمت مثبت ژل حرکت کند. قطعات کوتاهتر DNA سریعتر از قطعات بلندتر حرکت میکنند، بنابراین در مدت زمانی که جریان برقرار است، فاصله بیشتری را طی میکنند.
فاصلهای که DNA در ژل مهاجرت کرده است میتواند با نظارت بر حرکت رنگ بارگذاری بافر به صورت بصری ارزیابی شود. جریان الکتریکی به مدت کافی روشن نگه داشته میشود تا اطمینان حاصل شود که قطعات DNA به اندازه کافی در ژل حرکت کرده و از هم جدا شوند، اما نه آنقدر طولانی که از انتهای ژل خارج شوند.
مشاهده نتایج
زمانی که DNA به اندازه کافی در ژل مهاجرت کرده است، جریان الکتریکی خاموش شده و ژل از تانک الکتروفورز خارج میشود. برای مشاهده DNA، ژل با یک رنگ فلورسنت که به DNA متصل میشود رنگآمیزی میشود و بر روی یک ترنسایلومیناتور ماوراء بنفش قرار میگیرد که DNA رنگآمیزی شده را به صورت نوارهای روشن نشان میدهد.
به طور جایگزین، میتوان رنگ را قبل از ریختن ژل با آن مخلوط کرد. در روشی دیگر ژل به یک محفظه دارای اتیدیوم برماید برده میشود و پس از 15 دقیقه با دستگاه ژل داک قابل مشاهده خواهد بود.
اگر ژل به درستی عمل کرده باشد، الگوی نوارهای نشانگر DNA/استاندارد اندازه قابل مشاهده خواهد بود. سپس میتوان اندازه DNA در نمونه خود را با تصور یک خط افقی که از نوارهای نشانگر DNA عبور میکند، قضاوت کرد. شما میتوانید اندازه DNA در نمونه را با مطابقت دادن آنها با نزدیکترین نوار در نشانگر تخمین بزنید.
الکتروفورز مولکول DNA
تکنیک الکتروفورز به ما امکان میدهد تا مولکولهای DNA با طولهای مختلف را شناسایی کنیم. مولکولهای DNA به طور طبیعی دارای بار منفی هستند و هنگامی که بر روی ژل قرار میگیرند، با اعمال جریان الکتریکی به سمت الکترود مثبت حرکت میکنند. در این فرآیند، جداسازی مولکولهای DNA تنها بر اساس اندازه آنها صورت میگیرد. مولکولهای کوتاهتر DNA سریعتر از مولکولهای بلندتر روی ژل حرکت میکنند، بنابراین میتوان به راحتی مولکولهای DNA با اندازههای متفاوت را از هم تفکیک کرد. هنگام قرار دادن نمونهها در چاهکهای ژل، با افزودن رنگهای فلورسنت، میتوان مراحل بعدی را برای ردیابی نمونهها آسانتر کرد. گاهی رنگهای فلورسنت را پیش از ریختن ژل در قالبهای الکتروفورز با آن مخلوط میکنند، به طوری که هنگام قرار دادن نمونه دیگر نیازی به افزودن رنگ نیست. الکتروفورز DNA معمولاً به صورت افقی انجام میشود که نسبت به روش عمودی سادهتر است. پس از پایان حرکت نمونهها و قطع جریان الکتریکی، باندهای DNA با اندازههای مختلف بر روی ژل دیده میشوند. برای تعیین اندازه باندهای نمونه، از «نشانگر» (Ladder) به عنوان مرجع استفاده میشود. نشانگر به شکل باندهایی با طول معین بر روی ژل ظاهر میشود و به کمک آن میتوان اندازه باندهای نمونه را تخمین زد.
الکتروفورز پروتئینها با استفاده از الکتروفورز به روش PAGE
در فرآیند الکتروفورز برای جداسازی پروتئینها، عوامل مختلفی مانند بار الکتریکی و اندازه مولکولها تأثیرگذار هستند. اگر تمامی پروتئینها را با یکسان کردن بار الکتریکی آنها بارگذاری کنیم و تنها بر اساس اندازه آنها جدا کنیم، دقت و کارایی جداسازی به طرز چشمگیری افزایش مییابد. در روش PAGE (پلیآکریلامید ژل الکتروفورز)، با استفاده از SDS (دودسیل سولفات) به عنوان یک دترجنت آنیونی، تمامی پروتئینها بار منفی میشوند. SDS به نواحی آبگریز پروتئینها متصل شده و آنها را دناتوره میکند، به این ترتیب، بار الکتریکی پروتئینها یکنواخت میشود. پس از آن، در بستر پلیآکریلامید، پروتئینها بر اساس اندازهشان در طول ماتریکس ژل از هم جدا میشوند که این فرآیند با دقت بالا و با بهرهوری بالا انجام میشود.
جمعبندی
الکتروفورز یک تکنیک اساسی در بیوشیمی و زیستشناسی مولکولی است که برای جداسازی و تحلیل مولکولهای بیولوژیکی مانند پروتئینها، اسیدهای نوکلئیک و قطعات DNA استفاده میشود. در این مطلب از مجله ی بیوزوم آموختیم این روش بر اساس حرکت مولکولهای باردار در یک میدان الکتریکی عمل میکند که به دلیل تفاوت در بار، اندازه و شکل مولکولها، آنها را از یکدیگر جدا میکند و به ما امکان میدهد تا درک بهتری از ساختار و عملکرد مولکولهای بیولوژیکی به دست آوریم. توسعه و بهبود مستمر این تکنیک، میتواند به کشفهای علمی جدید و بهبود روشهای درمانی منجر شود.