میکروRNA
همانطور که میدانیم بخش اعظم ژنوم انسان را RNAهای غیرکدکننده تشکیل میدهد؛ که یکیاز مهمترین آنها میکروRNA ها هستند. miRNA ها، گروهی از مولکولها، با کاربردهایی شگفتانگیز هستند. یکیاز مهمترین کاربردهای میکروRNAها، تنظیم بیانژن میباشد؛ اما نقش miRNAها در سلول ، محدود به این مورد نمیشود و بسیار فراتر است. ازجمله سایر کاربردهای miRNAها میتوان به رشد و تکامل جنین، تشکیل اندامها، پاسخ اینمنی و حتی ایجاد انواع بیماریها مثل سرطان، بیماریهای خودایمنی وبیماریهای عفونی اشاره کرد. همچنین از میکروRNAها میتوان جهت درمان بسیاریاز بیماریها استفاده کرد. با مجله بیوزوم همراه باشید تا با دنیای شگفتانگیز microRNAها بیشتر آشنا شویم.
بیان ژن در سلول ها و بافت های هر موجود زندهی پیچیدهای، به دقت کنترل میشود و عمدتا به شرایط مختلفی (از جمله رشد، تغییرات محیطی، بیماری یا مصرف داروها) وابسته است. سلولها و سیستمهای اندامی مختلف در موجودات زنده ازجمله انسان، الگوهای بیان ژن متفاوتی دارند. بنابراین درک صحیح مکانیزمهای تنظیمی دخیل در بیان ژن، یکی از مسائل مهم پزشکی ژنومی است.
مولکولهای RNA غیرکدکننده، در بسیاری از فرآیندهای تنظیمی؛ از کنترل تعداد کپیهای DNA در تقسیم سلولی باکتریایی گرفته، تا غیرفعالسازی کروموزوم X در پستانداران، نقش دارند.
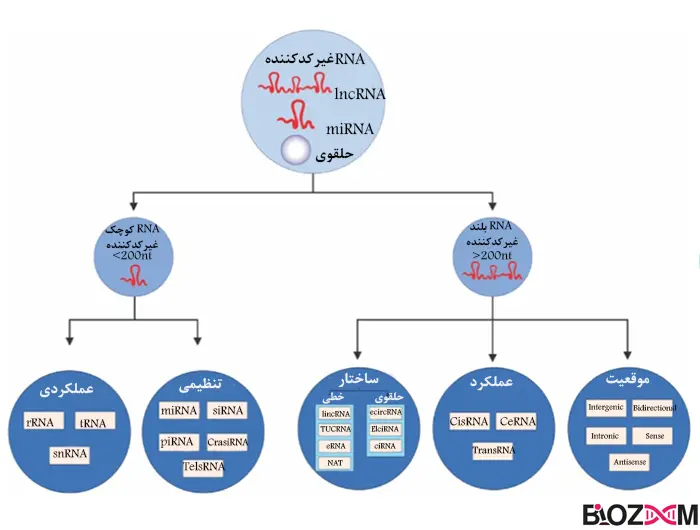
بررسیهای اخیر ژنوم انسان و حیوانات نشان داده است که بیشتر RNA های ساخته شده در سلول، (برخلاف RNA های پیامبر یا همان mRNAها) پروتئین تولید نمیکنند و بهعنوان RNA های غیرکدکننده (ncRNA) شناخته میشوند.
میکروRNA ها (miRNA ها)، دسته جدیدی از RNA های کوچک غیرکدکنندهی درونسلولی هستند که بیان ژن را تنظیم میکنند و این کار را با هدف قرار دادن mRNAها انجام میدهند؛ به اینصورت که یا mRNA را تخریب کرده و یا از ترجمه آنها به پروتئین جلوگیری میکند. کشف miRNAها باعث شددرکما از شبکههای پیچیده تنظیم بیانژن در انسان و حیوانات، به سطح جدیدی برسد.
میکروRNA چیست؟
میکروRNA ها، دستهای از مولکولهای کوچک غیرکدکننده هستند که در تنظیم بیانژن نقش دارند. این توالیهای کوتاه RNA که معمولا 25-20 نوکلئوتید طول دارند، به عنوان تنظیمکنندههای فرآیندهای مهم زیستی (از رشد سلول گرفته تا پیشرفت بیماری) شناخته شدهاند. از زمان کشف آنها در اوایل دهه 1990، miRNAها جایگاه ویژهای در زیستشناسی مولکولی پیدا کردهاند.
برخلاف mRNAها، microRNAها پروتئینی را کد نمیکنند؛ درعوض آنها به توالیهای خاصی در mRNA متصل شده و باعث تخریب آنها یا جلوگیری از ترجمهشان به پروتئین میشود. این تنظیم دقیق بیانژن میکروRNA را به عوامل مهمی در فرآیندهای سلولی مانند رشد، تمایز و آپوپتوز تبدیل کردهاست.
تااینجا آموختیم microRNAها دستهای از مهم از RNAهای غیرکدکننده هستند و عملکردهای گوناگونی دارند؛ درقسمت بعد قصد داریم به ساختار میکروRNA ها بپردازیم. با ما همراه باشید.
ساختار میکروRNA
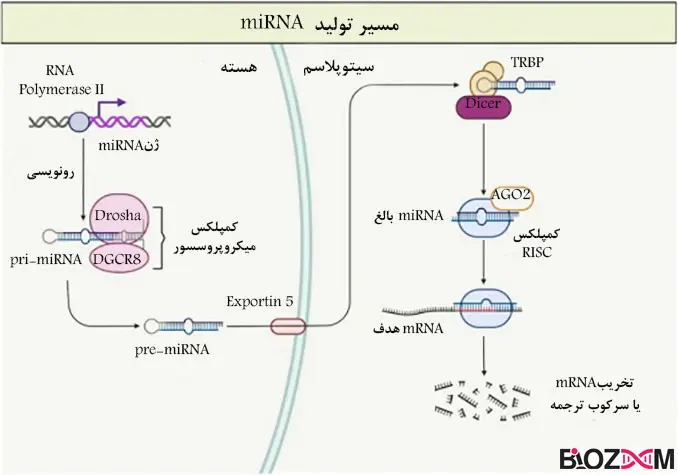
microRNAها ساختارهای گوناگونی دارند، آنها ابتدا در هسته به شکل پیشساز (pre-miRNA) تولید شده و سپس وارد سیتوپلاسم میشوند و طی مراحلی به بلوغ میرسند.
میکروRNA اولیه (pri-miRNA )
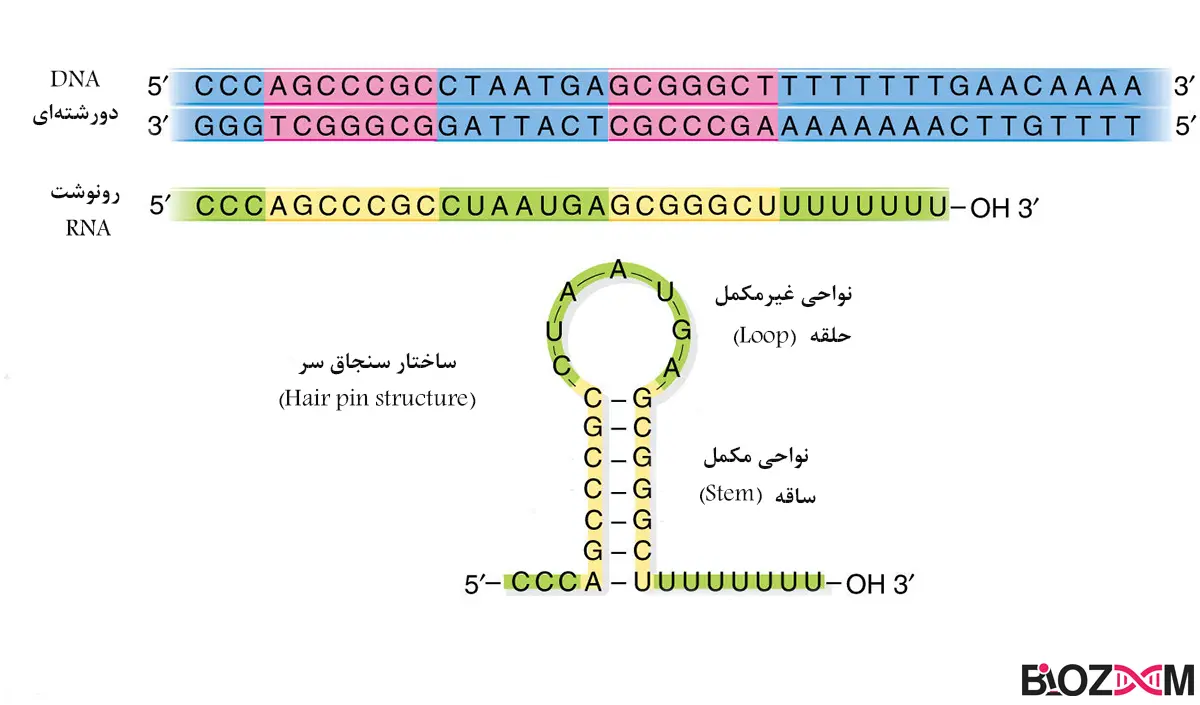
Pri-miRNAها رونوشتهای بلندی هستند که چندهزار کیلوباز طول دارند و در سر 5’ کلاهکگذاری شده و انتهای شده و انتهای 3’آنها پلیآدنیله شدهاست.
این نوع RNAها توسط RNAپلیمراز نوع2 رونویسی میشوند؛ همچنین دارای ساختارهای ساقه حلقه (stem-loop) میباشند که ناشی از جفت شدن بازهای مکمل در ساختار RNA میباشد که این ساختارها برای پردازشهای بیشتر میکروRNA ها ضروری هستند.
میکروRNA پیشساز (pre-miRNA)
Pre-miRNAها کوچکتر از pri-miRNA هستند و بهطور متوسط بین 100-70 نوکلئوتید طول دارند. آنها دارای یک ساختار سنجاق سر اختصاصی هستند که دارای یک ساقه متشکل از RNA دورشتهای و یک لوپ از RNA تکرشتهای در بخش بالای این ساختار است.
نحوه تشکیل pre-miRNA در هسته و انتقال آن به سیتوپلاسم
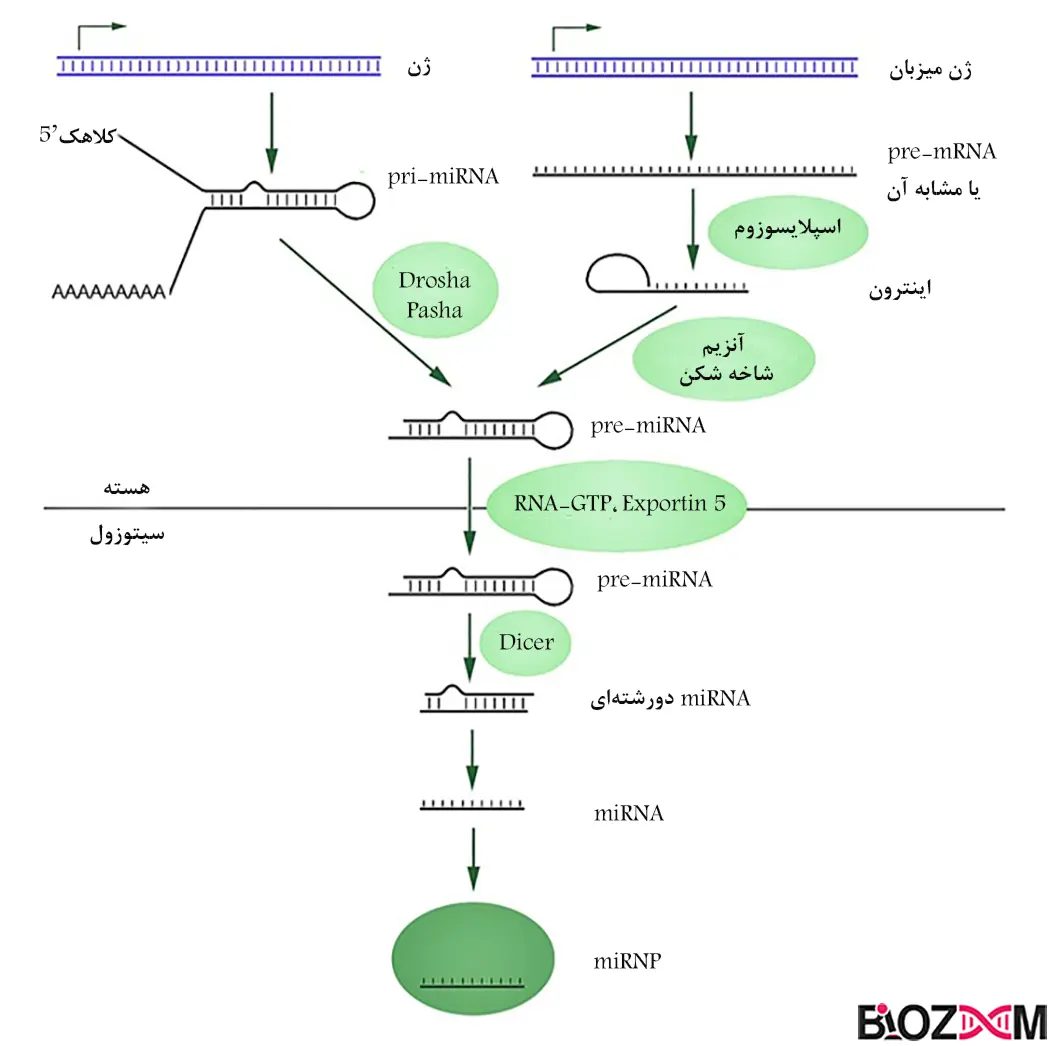
- تشکیل pre-miRNA در هسته: pri-miRNA در هسته تشکیل میشود و توسط یک کمپلکس پردازشگر به نام مجموعهی میکروپروسسور، (شامل آنزیم Drosha و کوفاکتور DGCR8 )مورد پردازش قرار گرفته و برش میخورد. نتیجهی این برش، تشکیل pre-miRNA حاوی ساختار سنجاق سر میباشد که طولی بین 100-70 نوکلئوتید دارد.
- انتقال pre-miRNA به سیتوپلاسم: در نهایت pre-miRNA تشکیل شده در هسته، توسط پروتئینی بهنام Exportin5 به سیتوپلاسم منتقل میشود. این انتقال برای پردازش نهایی و تبدیل pre-miRNA به miRNA بالغ، ضروری است.
میکروRNA بالغ
ویژگیهای میکروRNA بالغ (Mature miRNA)
1) اندازه: بین 25-20 نوکلئوتید است.
2) ساختار: miRNA بالغ یک مولکول RNA تکرشتهای است.
فرآیند بلوغ میکروRNA در سیتوپلاسم
آنزیم Dicer با برش pre-miRNA، باعث ایجاد یک miRNA بالغ دورشتهای با طولی در حدود 22 نوکلئوتید میشود. این دورشته شامل موارد زیر است:
رشته راهنما (Guide strand): فعال است و miRNA دارای عملکرد میباشد که وارد کمپلکس RISC (RNA-induced silencing complex) میشود.
رشته مسافر (Passenger strand ): غیرفعال است و تخریب میشود.
در این مرحله، miRNA بالغ فعال شده و آمادهی اتصال به mRNAهدف جهت تنظیم آن میباشد.
کمپلکس miRNA-RISC چیست؟
کمپلکس miRNA-RISC شامل شکل بالغ و عملکردی miRNA تکرشتهای و چندین پروتئین دیگر میباشد. مهمترین پروتئین در این ساختار، پروتئین آرگونات (AGO) است.
چگونه کار میکند؟رشتهی راهنمای میکروRNA در کمپکس RISC قرار میگیرد و آنرا به سمت mRNA هدف (عمدتا بخشهای غیرقابلترجمهی 3’ یا همان 3’UTR) راهنمایی میکند و در این بخش از طریق جفت بازهای مکمل باهم جفت میشوند و اگر این دوبخش کاملا مکمل هم باشند، mRNA هدف تجزیه میشود و اینگونه در فرآیند تنظیم بیانژن ایفای نقش میکند.
شناسایی ساختار میکروRNA
1)pri-miRNA: رونوشت بلند و کلاهکگذاری شده با یک یا تعداد بیشتری ساختار سنجاقسر میباشد.
2) pre-miRNA: طول کوتاهتری دارد (حدود 100-70 نوکلئوتید) و دارای ساختار سنجاقسر میباشد.
3) miRNA بالغ: RNA تکرشتهای با طول 25-20 نوکلئوتید است که در کمپلکس RISC قرار میگیرد.
تولید میکروRNA
سنتز میکروRNA شامل چندین مرحله است:
1) تولید pri-mRNA در هسته: RNAپلیمراز نوع 2، از روی ژن miRNA رونویسی کرده و miRNA اولیه (pri-mRNA) تولید میشودکه توالی بلندی دارد و ممکن است شامل چندین miRNA باشد.
2) برش pri-miRNA به pre-miRNA :pri-miRNA در هسته توسط کمپلکس Drocha-DGCR8 برش میخورد و miRNA پیشساز (pre-miRNA) تولید میشود که حدود 70 نوکلئوتید طول دارد.
3) انتقال به سیتوپلاسم: pre-miRNAتوسط Exportin5 به سیتوپلاسم منتقل میشود و در آنجا مورد پردازش بیشتر قرار گرفته و توسط آنزیم Dicer که نوعی RNase III میباشد، به miRNA دورشتهای با طول 24-19 نوکلئوتید برش میخورد که یک رشتهی آن در کمپلکس RISC قرار میگیرد و به واسطهی جفت شدن با mRNA هدف، در خاموشسازی ژن موردنظر نقش دارد.
حدود 40% mRNAها ممکن است داخل اینترونها یا اگزونها قرار بگیرند که معمولا همجهت با ژن میزبان قرار گرفته و همراه آن تنظیم میشوند. الگوی DNA تنها عامل تعیینکننده در تولید miRNA نیست، بلکه عوامل دیگری ازجمله تغییرات اپیژنتیکی، ساختار کروماتین و شرایطمحیطی نیز در نوع microRNA تولیدی موثر اند. برای مثال ممکن است وقوع متیلاسیون سبب خاموش شدن ژن سازندهی نوع خاصی از microRNA شود. حدود 6% از miRNAهای انسانی ویرایش میشوند که به آنها ایزومر میگویند؛ این فرآیند باعث افزایش تنوع miRNAها میشود.
رونویسی
ژنهای میکروRNA معمولا توسط RNA polymerase II رونویسی میشوند. آنزیم پلیمراز به یک پروموتر در نزدیکی توالی DNA متصل میشود؛ که این ناحیه درنهایت به ساختار سنجاقسر (Hair pin) در pre-miRNA تبدیل میشود. سپس انتهای 5’ رونوشت حاصل با اضافه شدن یک نوکلئوتید اختصاصی تغییریافته، کلاهکگذاری میشود و در انتهای 3’ آن پلیآدنیلاسیون رخ میدهد؛ دم پلیA اضافه میشود و درنهایت مورد پیرایش قرار میگیرد.
در جانوران، ژنهای میکروRNA در ابتدا به pri-miRNA رونویسی میشوند که حاوی یک توالی 80 نوکلئوتیدی با ساختار سنجاقسر (Hair pin) میباشد و درنهایت به miRNA بالغ تبدیل میشود. اگر این ساختار سنجاقسر در انتهای 3’ قرار داشتهباشد، این مولکول میتواند همزمان نقش pri-miRNA (تنظیم بیانژن) و mRNA ( ساخت پروتئین) را ایفا کند
I am text block. Click edit button to change this text. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Ut elit tellus, luctus nec ullamcorper mattis, pulvinar dapibus leo.
بیشتر miRNAها توسط RNA polymerase II رونویسی میشوند اما برخی از آنها مثل توالیهای Alu، tRNA یا MWIR ( توالیهای تکرار پراکنده در ژنوم پستانداران) توسط RNA polymerase III رونویسی میشوند.
پردازش هستهای
یک pri-miRNA میتواند از یک تا شش پیشساز miRNA تشکیل شود و ساختار آن به شکل یک حلقه سنجاقی متشکل از 70 نوکلئوتید است. در طرفین این ساختار سنجاقسری، توالیهایی قرار دارند که برای پردازش درست pri-miRNA ضروری است.
RNA دورشتهای در ساختار سنجاق سر pri-miRNA، توسط یک پروتئین هستهای بهنام DGCR8 (DiGeorge Syndrome Critical Region 8 ) شناسایی میشود؛ این پروتئین بهدلیل ارتباطش با سندروم DiGeorge به این نام شناخته شدهاست.
پروتئین DGCR8 در همراهی با Drosha ، کمپلکس میکروپروسسور را تشکیل میدهد. DGRC8 به بخش کاتالیتیک Drosha متصل میشود و باعث برش در pri-miRNA در 11 نوکلئوتید بالادست بخش حلقه شده و pre-miRNA ( miRNA پیشساز) حاصل میشود. Pre-miRNA حاصل، دارای یک انتهای3’OH و یک انتهای 5’ فسفات است. توالیهای پاییندست pre-miRNA که برای پردازش ضروری هستند، توسط کمپلکس میکروپروسسور شناسایی میشود و کمک میکند پردازش آن به درستی انجام شود.
Pre-miRNAهایی که مستقیما از برش خوردن اینترونها حاصل میشوند و از کمپلکس میکروپروسسور عبور نمیکنند، مینترون (mintron) نام دارند. مینترونها در Drosophila (مگس سرکه)، C.elegans و پستانداران یافت شدهاست.
حدود 16% از pre-miRNAها از طریق ویرایش RNA درهسته تغییر مییابند . RNA بیشتر توسط آنزیمهایی بهنام آدنوزین دآمیناز انجام میگیرد که کارشان تبدیل آدنوزین (A) به اینوزین (I) میباشد. ویرایش RNA میتواند پردازش هستهای را متوقف کند (مثل pri-miR-142 ) و باعث تخریب آن توسط آنزیمهای خاص میشود. همچنین با راخ دادن ویرایش در seed region میتواند مانع از اتصال miRNA به mRNA هدف شود. اگر ویرایش در miR-376 در سیستم عصبی رخ دهد، باعث تغییر seed region شده و درنتیجه این miRNA به mRNAهای دیگری ( غیر از mRNA هدف) متصل میشود.
Pre-miRNA ای که دارای ساختار سنجاقسر میباشد، توسط پروتئین Exportin 5 ( عضوی از خانواده کایروفرینها)، از هسته به سیتوپلاسم منتقل میشود.
آنزیم Drosha از طریق برش در pre-miRNA ، دو انتهای 3’ آویزان (3’Overhang) ایجاد میکند که توسط Exportin 5 شناسایی شده و در نتیجه pre-miRNA را از هسته به سیتوپلاسم منتقل میکند. این انتقال نیاز به انرژی دارد؛ که این انرژی توسط Ran (که یک پروتئین GTPase است)، تامین میشود.

پردازش سیتوپلاسمی
در سیتوپلاسم، بخش سنجاقسری pre-miRNA توسط آنزیم Dicer که نوعی RNaseIII است، برش میخورد. این آنزیم با انتهاهای 3’ و 5’ ساختار سنجاقسر (Hair pin) واکنش داده و بخش حلقه (Loop) را جدا میکند. miRNA دورشتهای حدود 22 نوکلئوتید طول دارد. به طورکلی، طول ساختار سنجاقسر، اندازه ی حلقه و جفت شدن miRNA تاثیر زیادی بر کارایی آنزیم Dicer در پردازش آن دارد.
برخیاز پیشسازهای miRNA که غنی از گوانین (G) هستند، میتوانند به جای ساختار سنجاقسر، ساختارهای G-quadroplex تشکیل دهند که در برابر آنزیم Dicer در سیتوپلاسم مقاوم هستند.
اگرچه هریک از دورشته میتوانند بهعنوان میکروRNA عملکردی باشند، اما فقط یک رشته وارد کمپلکس RISC شده و با mRNA هدف واکنش میدهد. درحالیکه بیشتر miRNAها درون سلول قرار دارند، اما برخی از آنها در محیط خارجسلولی یافت میشوند و تحت عنوان miRNAهای گردشکننده یا miRNAهای خارجسلولی شناخته میشوند.
تولید میکروRNA در گیاهان
تولید miRNA در گیاهان، در مراحل پردازش هستهای و انتقال به خارج از هسته، تفاوتهایی با جانوران دارد:
1) برخلاف جانوران که برش توسط دو آنزیم انجام میشود (یکی در هسته و دیگری در سیتوپلاسم)، در گیاهان هردو برش توسط آنزیمی بهنام Dicer-Like1 (DL1) (هومولوگ آنزیم Dicer در جانوران) انجام میشود. DL1 تنها در هسته سلولهای گیاهی بیان میشود که نشاندهندهی این است که هردو واکنش برش، داخل هسته رخ میدهد.
2) قبلاز انتقال miRNA به سیتوپلاسم، انتهای 3’ آن توسط آنزیم Hua-Enhancer1 (HEN1) که نوعی متیل ترانسفراز است، متیله میشود. سپس miRNA توسط پروتئین Hasty (HST) ( هومولوگ Exportin 5 در جانوران)، از هسته به سیتوپلاسم منتقل میشود؛ جاییکه دورشته جدا شده و miRNAی تکرشتهای وارد کمپلکس RISC میشود.

نقش میکروRNA
microRNAها نقشهای گوناگونی دارند که از جمله مهمترین آنها میتوان به تنظیم بیانژن، از طریق اتصال به mRNA هدف اشاره کرد. میکروRNA ها همچنین در فرآیندهای مهم زیستی از جمله رشد و تکامل، پاسخ ایمنی و بیماری سرطان نقش دارد. در ادامه به توضیح کامل این نقشها میپردازیم.
1) رشد و تکامل: microRNAها نقش حیاتی در رشد و تکامل دارند. آنها میتوانند بیانژن را در مراحلخاصی کنترل کنند. همچنین آنها مسیرهای گوناگونی را برای تمایز سلولهای بنیاری و تبدیل شدن به انواع سلولهای مختلف تنظیم میکنند. علاوهبراین، میکروRNAها در تشکیل اندامها و بافتهای بدن نیز نقش دارند.
مطالعات روی آنزیم Dicer، نشان میدهد که اگر این آنزیم در مراحل اولیهجنینی از کار بیفتد، باعث ایجاد ناهنجاریهای ساختاری در جنین میشود. همچنین در موشها و مگسسرکه، حذف Dicer باعث مرگجنینی میشود.
چند مثال از microRNAهای دخیل در رشد و تکامل اندامها:
miR-273: برای تکامل سیستم عصبی
miR-1: برای شکلگیری قلب
miR-27: برای تمایز میوسیتها در حین تکامل عضلات اسکلتی
miR-127: برای انشعاب ریهها
ازطرفدیگر، بعضیاز miRNAها مثل let-7،پس از شروع تمایز سلولی افزایش مییابد و باعث سرکوب پرتوانی در سلولهای بنیادی تمایزیافته میشود.
2) تکثیر و مرگ سلولی: microRNAها تقسیم و بقای سلول را القا یا سرکوب میکنند. بنابراین نقش کلیدی در حفظ تعادل بین رشد سلولی و مرگ برنامهریزی شده (آپوپتوز) دارند. این تنظیم، برای رشد طبیعی بافتها و هموستاز سلولی، حائز اهمیت است.
3) پاسخ ایمنی: microRNAها مسئول کنترل رشد و عملکرد سلولهای ایمنی هستند؛ به این معنا که بر نحوهی پاسخ موجودزنده، به عفونت و التهاب، تاثیرگذارند. برای مثال فعالسازی و تمایز ماکروفاژها توسط miR-125b (فاکتور دخیل در مسیر NFKB)، کنترل میشود.
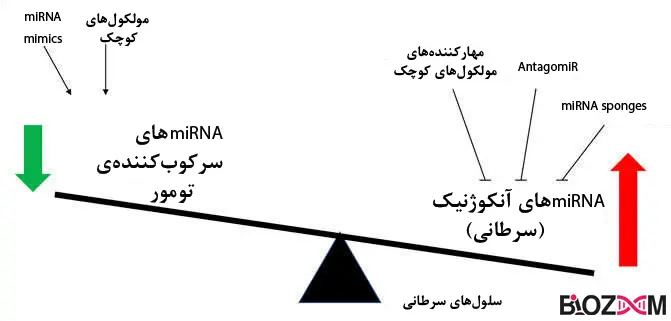
4) سرطان: اختلال در بیان microRNAها، در انواع مختلف سرطانها مشاهده میشود. برخی از میکروRNAها، سرکوبگر تومور (tumor suppressor) و برخی دیگر به عنوان آنکوژن عمل میکنند، که باعث رشد سلولهای سرطانی میشود. عدم تعادل در بیان این miRNAها، منجربه تکثیر غیرقابل کنترل سلولها، متاستاز و مقاومت به شیمیدرمانی میشود.
عملکرد سلولی میکروRNA ها
نقش میکروRNA ها در تنظیم ژن است؛ برای این منظور، miRNA به بخشی از یک یا چند mRNA با توالی مکمل، متصل میشود. miRNAهای جانوری معمولا با ناحیه 3’UTR مکمل اند و به آن متصل میشوند، درحالیکه miRNAهای گیاهی، معمولا به بخشهای کدکنندهی mRNA متصل میشوند. در گیاهان اتصال کامل یا تقریبا کامل با mRNA، باعث تجزیهی آن میشود؛ اما در جانوران، اتصال miRNA با mRNA ناقص بوده و معمولا باعث مهار ترجمه میشود. برای اینکه میکروRNAهای با تطابق ناقص، بتوانند mRNA هدف را شناسایی کنند، 2 تا 7 نوکلئوتید آن (seed region)، باید کاملا مکمل mRNA باشد. (در گیاهان این حالت کمتر رایج است.)
میکروRNA ها همچنین میتوانند فرآیند دآنیلاسیون را تسریع کنند و منجر به تخریب سریعتر mRNA شوند. هنوز بحثهای زیادی در مورد اینکه مهار ترجمه به چهصورت انجام میشود، وجود دارد؛ مشخص نیست که این مهار از طریق تجزیهی mRNA، مهار مستقیم یا ترکیبی از هردو انجام میشود. مطالعات اخیر روی ژن miR-430 در گورخرماهی و miR-9 در مگس سرکه، نشان میدهد که سرکوب ترجمه از طریق اختلال در آغاز ترجمه روی میدهد و ربطی به دآدنیلاسیون mRNA ندارد.
گاهیاوقات میکروRNA ها باعث ایجاد تغییرات اپیژنتیکی در هیستونها و متیلاسیون DNA در نواحی پروموتر میشوند که بر بیان ژنهای مختلف اثرگذار است.
9 مکانیزمی که میکروRNA میتواند بیانژن را تنظیم کند
1) مهار شروع ترجمه (Cap-40S initiation inhibition): miRNA از اتصال ریبوزوم به انتهای 5’mRNA جلوگیری کرده و مانع از شروع ترجمه میشود.
2) ممانعت از اتصال زیرواحد 60s: مانع اتصال زیرواحد بزرگ ریبوزوم (60S) به زیرواحد کوچک آن (40S) میشود.
3) مهار طویلسازی (Elongation)
4) جداشدن زودهنگام ریبوزوم: ریبوزوم، زودتر از رسیدن به کدون خاتمه و اتمام ترجمه، از mRNA جداشده و پروتئینی ناقص ساخته میشود.
5) تجزیهی همزمان پروتئین درحال سنتز: پروتئینی که درحال ترجمه است، بلافاصله تخریب میشود.
6) تخریب mRNA توسط اجسام P (P.boddies)
7) تجزیه و کاهش پایداری mRNA
8) برش mRNA
9) مهار رونویسی از طریق تغییرات کروماتین بهواسطهی میکروRNA ها: میکروRNA ها گاهیاوقات میتوانند ساختارپروتئین را تغییر داده و باعث خاموشیژن شوند.
هرکدام از این واکنشها، دینامیک و الگوی سرعت (کینتیک) خاصی دارند که با بررسی اینموارد میتوان به نوع واکنش پی برد.
برخلاف microRNAهای گیاهی، miRNAهای جانوری، ژنهای متنوعی را هدف قرار میدهند. ژنهایی که در همهی سلولها نقش حیاتی دارند، معمولا کمتر مورد هدف میکروRNAها قرار میگیرند.
RNAهای دورشتهای (dsRNA) علاوهبر نقش در خاموش کردن ژن، میتواند در فعال شدن بیانژن هم نقش داشته باشد؛ که این مکانیزم، فعالسازی ژن با RNA کوچک (RNAa) نامیده میشود. dsRNAهایی که پروموتر ژن را مورد هدف قرار میدهند، باعث فعالسازی رونویسی ژن مربوطه میشوند. این فرآیند در سلولهای انسانی، با استفاده از dsRNAهای مصنوعی (saRNA) اثبات شدهاست. البته برخی microRNAهای طبیعی هم میتوانند با توالی مکمل روی ژنها و حتی ژنهای کاذب (pseudogenes) تعامل داشتهباشند؛ که این تعامل میتواند باعث تنظیم سطح بیانژنهای پارالوگ (ژنهایی که از یک ژناجدادی مشترک منشاء گرفتهاند) شود. این فرآیند، RNAهای اندوژن رقابتی (ceRNA) نام دارد. این microRNAها به نواحی پاسخدهنده (Response element) برروی ژنهای کاذب متصل میشوند. این فرآیند میتواند توضیحی برای حفظ توالی غیرکدکنندهی DNA باشد.
میکروRNA های خارجسلولی و نقشهای آن
1) تشخیص بیماریها: برخیاز microRNAها در مایعات خارجسلولی مثل خون و مایع مغزینخاعی در گردش اند که از اینها میتوان بهعنوان مارکر برای تشخیص برخیاز بیماریها استفاده کرد؛ چراکه در بیماریهای مختلف تعدادشان متفاوت است.
2) لانهگزینی جنین: همچنین میکروRNAهای خارجسلولی در لانهگزینی جنین نقش دارند و میتوانند برروی چسبندگی تروفوبلاست به آندومتر رحم اثر بگذارند.
3) ارتباط microRNA با ریتم شبانهروزی: miRNAهایی چون miR 183/96/182 با تنظیم ریتم شبانهروزی و خواب و بیداری ارتباط دارند. درنتیجه microRNAها نهتنها در داخل سلول باعث تنظیم بیانژن میشوند، بلکه میتوانند با حرکت در خارجسلول نیز، باعث اثر بر عملکرد سایر سلولها شود.
بیماریهای مرتبط با میکروRNA ها
تنظیم صحیح بیوژنز و عملکردmicroRNAها، نقش بسیار مهمی در رشد و تمایز دارد و به همین دلیل اختلال در تنظیم miRNAها با بیماریهای متعددی در انسان مرتبط است.
برخیاز مکانیزمهای شناختهشده در این اختلالات عبارتند از
1) افزایش یا کاهش بیان microRNAها
2) اختلال در عملکرد فاکتورهای رونویسی miRNA
3) تغییرات اپیژنتیکی مانند هایپرمتیلاسیون و استیلاسیون هیستونها روی miRNA که منجربه خاموش شدن ژن میشود.
4) اختلال در بیوژنز miRNA بهدلیل عملکرد نادرست آنزیمهای RNase III مثل Drosha و Dicer
ارتبط بین اختلالات microRNA و سرطان، اولین بار در سال 2002 کشف شد. کالین و همکارانش، دوژن miR15a و miR16-1 که سرکوبگر تومور و تنظیمکنندهی آپوپتوز هستند را کشف کردند که مقدارشان در لوسمی لنفوسیتی مزمن سلول B کاهش مییابد.
برخیاز تغییرات در میزان بیانژن که باعث سرطان میشوند، عبارتند از:
1) افزایش بیان miR-21: سرکوب فاکتور رونویسی LZTFL7 که باعث تکثیر و متاستاز سلولهای سرطان پستان میشود.
2) افزایش بیان miR-185 و کاهش بیان miR-133b در سرطان کولورکتال با متاستاز بالا
3) کاهش بیان miR-29b که باعث تبدیل سلولهای اپیتلیال به مزانشیم (EMT)، در سرطان پروستات میشود.
4) افزایش بیان miR-21 که باعث تحریک آنژیوژنز (رگزایی)، با هدف قراردادن ژن PTEN میشود.
اختلال در تنظیم میکروRNA علاوهبر سرطانها در تعدادی از بیماریهای عفونی و غیرعفونی نیز نقش دارند. برای مثال ویروس HIV برای اینکه بتواند در بدن تکثیر پیدا کند، بیان microRNA را سرکوب میکند.
مایکوباکتریوم توبرکلوزیس با افزایش بیان miR-99b ، پاسخ ایمنی در دندرتیکسلها و ماکروفاژها را تضعیف کرده و به سلول میزبان حمله میکند. همچنین اختلال در تنظیم microRNAها، در بیماریهای خودایمنی ازجمله MS و لوپوس (SLE) نیز مشاهده شدهاست.
نقش میکروRNA در درمان بیماریها
بهدلیل اینکه microRNAها در تعدادی از بیماریها نقش دارند، این مولکولها بهعنوان اهداف درمانی مورد توجه قرار گرفتهاند.
روشهای درمانی برپایه microRNA
1)مهار microRNA : اگر میکروRNA بیشازحد بیان شود، با استفاده از Anti-miRNAها (مولکولهای مهارکنندهی miRNA)، بیان آنرا سرکوب میکنند. درنتیجه سلول به فنوتیپ طبیعی خود نزدیک میشود.
2) جایگزینی microRNA : اگر میکروRNA کمتراز حد نرمال بیان شود، میتوان نسخه مصنوعی miRNA (miRNA mimics) را به آن اضافه کرد تا بیانژن را افزایش دهد.
میکروRNAها میتوانند اهداف درمانی جذابی باشند؛ چراکه یک miRNA میتواند چندین مسیرسلولی را تنظیم کند. درحالحاضر درمان چند بیماری وابسته به miRNA، تحت کارآزمایی بالینی اند؛ ازجمله این بیماریها میتوان به هانتینگتون، دیابت نوع2 ، سرطان ریه غیرکوچک (Non-Small Cell Lung Cancer)، سرطان کبد و نارسایی قلبی، اشاره کرد.
مشکل اصلی این روشدرمانی، تاثیرات غیراختصاصی (off-target effects) به دلیل طیف گستردهی مسیرهای سلولی میباشد. برای حل اینمشکل از miRNAهای مصنوعی (mimics) استفاده میشود. برای مثال، TargomiR(که نوعی داروی ضدسرطان برپایه miRNA است)، برای افزایش دقت هدفگیری، در ذرات نانوباکتریایی بستهبندی شده و با آنتیبادیهای اختصاصی تومور پوشانده شدهاست.
یکیاز راههای افزایش اثربخشی این نوع درمان، استفادهی همزمان از miRNA و داروهای متداول یا siRNA (RNAهای کوچک مداخلهگر) میباشد. برای مثال : 1) ترکیب miR-159 با داروی دوکسوروبیسین، باعث کاهش مقاومت دارویی در سرطانپستان سهگانهمنفی میشود. 2) ترکیب پلاسمید نوترکیب حاوی miRNA با siRNA ، باعث تاثیرگذاری بر سلولهای سرطان ریه میشود.
بهطورکلی مزیت این رویکرد نوین در پزشکی، کاهش مقاومتدارویی، افزایش اثربخشی و هدفگیری دقیقتر سلولهای سرطانی میباشد.
یکیدیگر از روشهای درمانی، استفادهاز miRNA Sponges میباشد که دارای چندین محل اتصال برای miRNAهای مختلشده است؛ بهعبارتی میتوان با اینروش چندین miRNA را همزمان تنظیم کرد. اثرگذاری اینروش در مدلهای موشی برای بیماریهای قلبی-عروقی و در سلولهای سرطانسینه، اثبات شدهاست.
جمعبندی
همانطور که گفتهشد، microRNAها، RNAهای کوچک و غیرکدکننده هستند که با اتصال به mRNAهدف، باعث تخریب آن و مهار ترجمه میشود. ازجمله نقشهای کلیدی آن میتوان به رشد و تمایز سلولی، پاسخ ایمنی و نقش در انواع بیماریها ازجمله سرطان اشاره کرد. میکروRNAها با تنظیم بیانژن ، نقش کلیدی در سلامت و بیماری دارند و دارای کاربردهای درمانی بسیاری نیز میباشند.
سوالات متداول
siRNA چیست؟
siRNA یا RNAهای کوچک مداخلهگر (Small Interfering RNA)، RNAهای دورشتهای هستند که با قرارگرفتن داخل کمپلکس RISC موجب اتصال به mRNA هدف، توقف ترجمه و درنتیجه خاموش شدن ژن مدنظر میشود.
OncomiR چیست؟
آنکومیرها (OncomiR)، microRNAهای سرطانزا هستند که از طریق مهار ژنهای سرکوبکنندهی تومور یا افزایش بیانژنهای آنکوژنیک، سبب ایجاد سرطان میشوند. برای مثال miR-21 که نوعی آنکومیر است، در سرطان سینه افزایش بیان چشمگیری دارد. یکی از روشهای درمان سرطان، استفاده از antagomiR ها است که موجب مهار OncomiRها میشود.
hnRNA چیست؟
RNAهستهای ناهمگن (Hererogeneous Nuclear RNA)، پیشساز اولیه و پردازشنشدهی RNA در هستهی سلول است و دارای بخشهای اضافه میباشد که باید حذف گردد. hnRNA پس از پردازش، تبدیل به mRNA بالغ میشود.