باکتریوفاژ | چیستی، ساختار، ویژگیها و نقشها
با گذشت زمان، رمز و رازهایی از زندگی ما را در سرزمینهای کوچک و شگفتانگیز میکروبی کشف میکنیم. از آغاز رازآلود حیات بر روی کره زمین تا ایجاد بیماریهای پرنفوذ، همه به دستان نامرئی باکتریها و میکروارگانیسمهای پروکاریوتی اتفاق افتاده است که در این اکوسیستم بزرگ جهان، تأثیرات عمیقی بر زندگی ما دارند. میکروارگانیسمها، در داخل بدن انسان و سایر موجودات پرسلولی، به تعدادی از ما بیشتر از دانههای شن در ساحل هستند. آنها در هر ناحیه از زندگی ما، از تغذیه گرفته تا دفاع و سیستم ایمنی، نقش مهمی ایفا میکنند. بنابراین، درک عمیق از این روابط میکروبی، یکی از کلیدهای سلامتی و رفاه ماست. باکتریوفاژ ها ویروسهایی هستند که باکتریها را آلوده میکنند و میتوانند در زمینههای مختلف برای انسان مهم باشند. پس به جهان معجزهای از میکروکیهان خوش آمدید! ما در مجله بیوزوم به توضیح ساختار و توزیع فاژها و نقش آنها بر تکامل میزبان و پویایی جمعیت میپردازیم. پس با ما همراه باشید.
باکتریوفاژ ها که فاژ نیز نامیده میشوند (از ریشه کلمه “phagein” به معنای “خوردن” میباشند)، ویروسهایی هستند که باکتریها را آلوده میکنند و از تشکیلات و سازمان سلولی آنها برای تکثیر خود استفاده میکنند، این ویروسها را میتوان در هر جایی که باکتریها وجود دارند، از جمله در خاک، اعماق پوسته زمین، داخل گیاهان و حیوانات و حتی در اقیانوسها یافت. اقیانوسها دارای متراکمترین منابع طبیعی فاژها در جهان هستند.
باکتریوفاژ ها در فاز خارج از سلول یا به عبارت دیگر ویریون خود (extracellular phase)، از یک اسیدنوکلئیک (RNA یا DNA دو رشتهای یا تکرشتهای) تشکیل شدهاند که توسط یک پوشش پروتئینی به نام کپسید احاطه شده است. کپسید ممکن است شامل ساختارهای خارجی اضافی مانند دم یا اسپیکول باشد و در برخی موارد کمتر، پوشش لیپیدی خارجی داشته باشد.
ساختار باکتریوفاژ چیست؟
ساختار باکتریوفاژ ها با ترکیب سادهای متشکل از مواد ژنتیکی، DNA یا RNA محصور در کپسید پروتئینی مشخص میشود. این ویروسها ممکن است ساختارهایی از ساده تا پیچیده داشته باشند. به طور معمول، ماده ژنتیکی از DNA یا RNA دو یا تکرشتهای تشکیل شده است و کپسید میتواند اشکال مختلفی مانند ساختارهای بیستوجهی (Icosahedral)، رشتهای یا سر – دم داشته باشد. سر یک باکتریوفاژ اغلب حاوی ژنوم ویروسی است، درحالیکه دم در اتصال به گیرندههای خاص در سطح سلول میزبان نقش دارد. برخی از باکتریوفاژها دارای فیبرهای دم و پینهای (میخهای) دم هستند که به شناسایی و اتصال سلول میزبان کمک میکند. باکتریوفاژ ها بر اساس این ویژگیها توسط کمیته بینالمللی تاکسونومی ویروسها (ICTV) طبقهبندی میشوند.
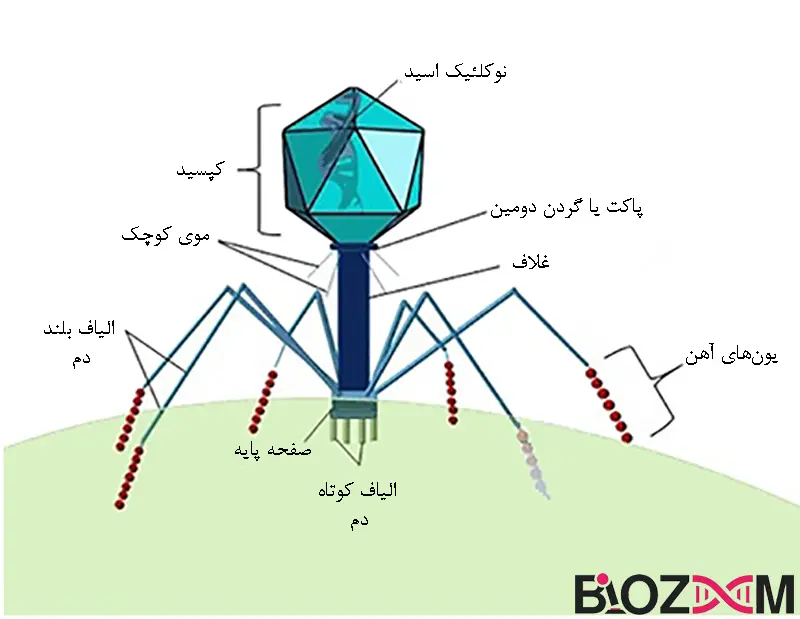
ویژگیهای باکتریوفاژها
1- پایداری در محیط
ویریونها به دلیل ساختار و ترکیب خود میتوانند در محیط باقی بمانند و در برابر تنشهای طبیعی و انسانی مقاومت کنند.برای مثال، باکتریوفاژ هایی که باکتریهای روده را آلوده میکنند، بهتر از باکتریهای میزبان خود در محیط خارج از روده انسان باقی میمانند.
2- توانایی آلودگی باکتری
یک فاژ میتواند طیف وسیعی از باکتریها را آلوده کند و یا توانایی آلودهکردن گروههای خاصی را داشته باشد، حتی تنها روی سویههای خاصی از همان گونههای باکتریایی تأثیر بگذارد. این بستگی به گیرندههای بیانشده در سطح سلول میزبان دارد که فیبرها و میخهای دم فاژ به آنها متصل میشود و فرایند عفونت را آغاز میکند.
3- چرخه تکثیر فاژ
فاژها در دو چرخه تکثیر میشوند: لیتیک (Lytic) و لیزوژنیک (Lysogenic) در چرخه لیتیک، بلافاصله پس از نفوذ فاژ به باکتری، فاژها تکثیر میشوند و در نهایت دیوارههای میزبان خود را از داخل پاره میکنند و بسته به فاژ و وضعیت فیزیولوژیکی باکتری، تعداد ۱۰۰۰-۱۰ زاده را آزاد میکنند. فاژهای ویروسی که از این چرخه پیروی میکنند میتوانند آن را در مدتزمان کوتاهی به ۳۰ دقیقه کامل کنند.
در مقابل، فاژهای معتدل (Temperate) (فاژهایی که هر دو چرخه لیتیک و لیزوژنیک را دارند) یک چرخه لیزوژنیک را دنبال میکنند، که طی آن فاژ DNA خود را به باکتری تزریق میکند که در ژنوم باکتری (Prophage) ادغام شده و همراه با آن تکثیر میشود. این وضعیت تا زمانی که پروفاژ تولید (تکثیر) شود (به طور خودبهخود یا توسط عوامل خارجی) حفظ میشود و با جداشدن از ژنوم و پیروی از چرخه لیتیک و تولید نتایج جدید به حالت اولیه خود باز میگردد.
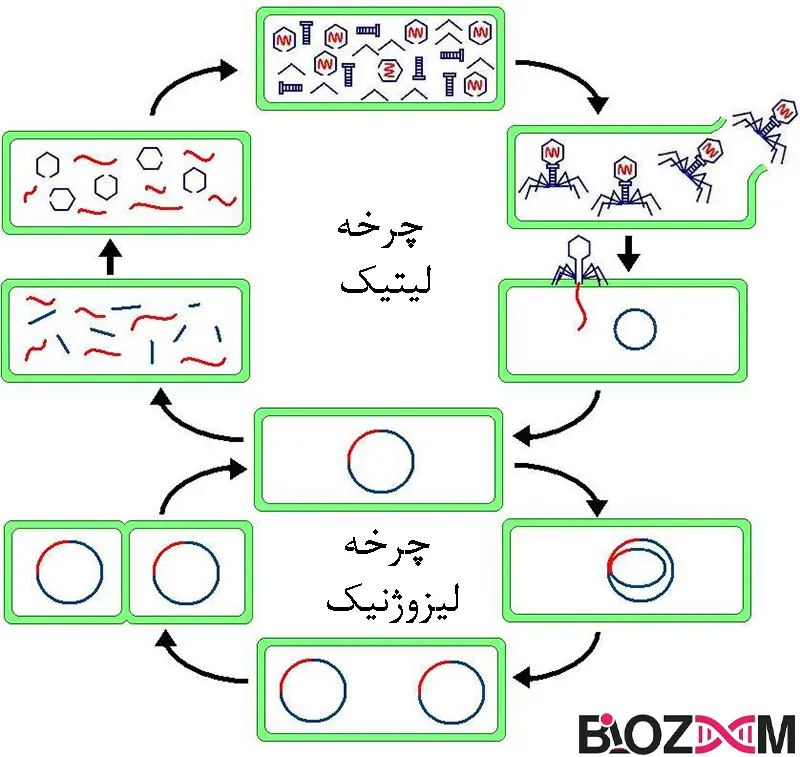
چرخههای زندگی دیگر، از جمله شبه لیزوژنی (Pseudolysogeny) و عفونت مزمن (chronic infection) نیز وجود دارد. در شبه لیزوژنی، یک باکتریوفاژ وارد سلول میشود؛ اما نه ماشین تکثیر سلولی را انتخاب میکند و نه به طور پایدار در ژنوم میزبان ادغام میشود. شبه لیزوژنی زمانی اتفاق میافتد که یک سلول میزبان با شرایط رشد نامطلوب مواجه میشود و به نظر میرسد با توانایی حفظ ژنوم فاژ تا زمانی که شرایط رشد میزبان دوباره سودمند شود، نقش مهمی در بقای فاژ بازی میکند. در عفونت مزمن، ذرات فاژ جدید به طور مداوم در مدت زمان طولانی اما بدون کشتن سلولی ظاهر میشوند
4- عملکرد باکتریوفاژ ها در طبیعت
فاژها هم در طبیعت و هم در کاربردهای بالقوه دیگری مثل استفادهی آزمایشگاهی نقشهای متعددی دارند. بهعنوان مثال، باکتریوفاژ ها با واسطهگری در رشد باکتریها، تأثیرگذاری بر در دسترس بودن مواد مغذی، و کنترل تنوع میکروبی از طریق فشار انتخابی بر جمعیتهای باکتریایی بر اساس مقاومت به عفونت فاژ، تأثیر قابل توجهی بر چرخه ماده آلی در بیوسفر دارند. فاژها همچنین میتوانند با آلوده کردن میکروبهای کلیدی چرخه کربن بر روی دسترسی نیتروژن، یک ماده مغذی کلیدی در اکوسیستمهای زمینی تأثیر بگذارند. در سطح آزمایشگاهی، آنها همچنین نقشهای متعددی را به عنوان مدل و ابزار مولکولی تایپ یا نوع فاژ گونههای باکتریایی (روشی که باکتریها را بر اساس حساسیت آنها به فاژهای خاص دسته بندی میکند. این تکنیک در مطالعات اپیدمیولوژیک، شناسایی سویههای باکتریایی و درک تنوع و تکامل باکتریها ارزشمند است)، کاربردهای فاژدرمانی، مدلهای تکاملی و شاخصهای آلودگی مدفوع ایفا میکنند.
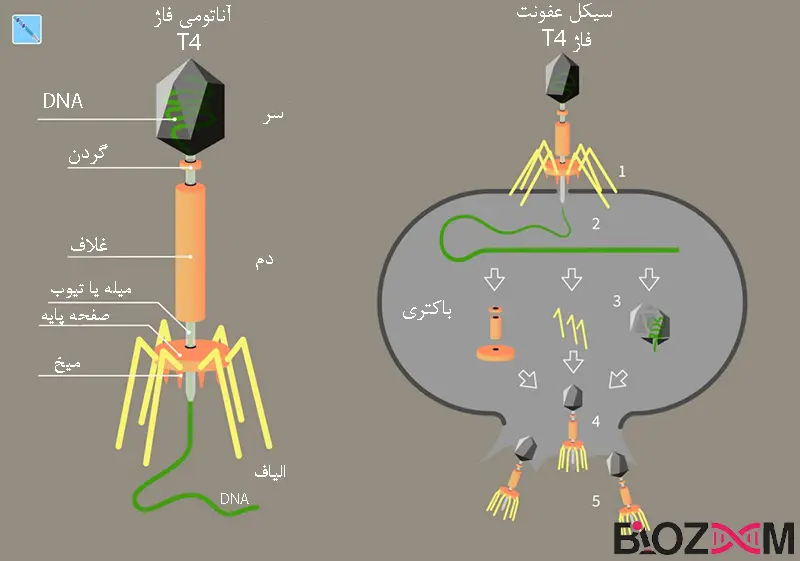
نقش فاژها در تحقیقات آزمایشگاهی
فاژها نقش مهمی در تحقیقات آزمایشگاهی داشتهاند. اولین فاژهای مورد مطالعه آنهایی بودند که از نوع 1 (T1) تا نوع 7 (T7) تعیین شده بودند. فاژهای T-even (T-even phages)، T2، T4 و T6 بهعنوان سیستمهای مدل برای مطالعه تکثیر ویروس استفاده شدند. در سال 1952 آلفرد دی هرشی (Alfred Day Hershey) و مارتا چیس (Martha Chase) از باکتریوفاژ T2 در آزمایشی معروف استفاده کردند که در آن نشان دادند که فقط اسیدهای نوکلئیک مولکولهای فاژ برای همانندسازی آنها در باکتریها مورد نیاز است. نتایج آزمایش این نظریه را تأیید کرد که DNA ماده ژنتیکی است. هرشی به دلیل کارش با باکتریوفاژها، در سال 1969 جایزه نوبل فیزیولوژی یا پزشکی را دریافت کرد. او این جایزه را با زیست شناسانی به نام سالوادور لوریا (Salvador Luria) و ماکس دلبروک (Max Delbrück)، به اشتراک گذاشت، آزمایشهای این دو دانشمند با فاژ T1 در سال 1943 (آزمایش نوسانات) نشان داد که مقاومت فاژی در باکتریها محصول جهش خود به خودی است و پاسخ مستقیم به عوامل محیطی نیست. فاژهای خاصی مانند لامبدا (lambda)، مو (Mu) و M13 در فناوری DNA نوترکیب استفاده میشوند. فاژ ϕX174 اولین ارگانیسمی بود که تمام توالی نوکلئوتیدی آن تعیین شد، شاهکاری که توسط فردریک سانگر (Frederick Sanger) و همکارانش در سال 1977 انجام شد.
در دهه ۱۹۸۰، بیوشیمیدان آمریکایی، جورج پی اسمیت (George P. Smith)، فناوری موسوم به نمایش فاژ را توسعه داد که امکان تولید پروتئینهای مهندسی شده را فراهم کرد. چنین پروتئینهایی با ادغام قطعات DNA خارجی یا مهندسی شده در ژن III فاژ تولید شدند. ژن III پروتئینی را کد میکند که در سطح ویریون فاژ بیان میشود. بنابراین، پروتئینهایی حاصل از ادغام ژن III بر روی سطوح ذرات ویریون نمایش داده شدند. سپس محققان میتوانند از آنتیبادیهای توسعهیافته برای شناسایی قطعه پروتئین خارجی برای خالصسازی کشتهای فیوژن فاژ استفاده کنند و در نتیجه توالی ژن خارجی را برای مطالعات بیشتر تقویت کنند.
گرگوری پی وینتر (Gregory P. Winter)، بیوشیمیدان بریتانیایی، متعاقباً فناوری نمایش فاژ را برای توسعه پروتئینهای آنتیبادی انسانی اصلاح کرد. چنین پروتئینهایی را میتوان برای درمان بیماریها در انسان با خطر کمتری برای ایجاد واکنشهای ایمنی بالقوه خطرناک در مقایسه با آنتیبادیهای درمانی قبلی مشتق شده از حیوانات استفاده کرد. آدالیموماب (Adalimumab) (Humira)، که برای درمان آرتریت روماتوئید استفاده میشود، اولین آنتیبادی کاملاً انسانی بود که از طریق نمایش فاژ ساخته شد که توسط سازمان غذا و داروی ایالات متحده تأیید شد (تأیید در سال ۲۰۰۲). اسمیت و وینتر به دلیل اکتشافات مربوط به نمایش فاژ، سهمی از جایزه نوبل شیمی ۲۰۱۸ را دریافت کردند.
باکتریوفاژها در مقابل آنتیبیوتیکها
قبل از کشف آنتیبیوتیکها، تحقیقات قابل توجهی در مورد باکتریوفاژ ها بهعنوان درمان بیماریهای باکتریایی انسان انجام شد. باکتریوفاژها فقط به باکتریهای میزبان خود حمله میکنند، نه سلولهای انسانی، بنابراین کاندیدای بالقوه خوبی برای درمان بیماریهای باکتریایی در انسان هستند.
پس از کشف آنتیبیوتیکها، رویکرد فاژ در بسیاری از نقاط جهان (بهویژه کشورهای انگلیسیزبان) تا حد زیادی کنار گذاشته شد. بااینحال، فاژها همچنان برای مقاصد پزشکی در تعدادی از کشورها از جمله روسیه، گرجستان و لهستان مورد استفاده قرار میگیرند.
در حال حاضر، در کشورهای دیگر علاقهای به بازگرداندن “رویکرد فاژ” به وجود آمده است. این امر به دلیل افزایش مشکلات مربوط به باکتریهای مقاوم به آنتیبیوتیک است. بااینحال، هنوز نیاز به تحقیقات بیشتری در این زمینه وجود دارد تا بتوانیم مطمئن شویم که فاژها چقدر ایمن و مؤثر هستند. اما چه کسی میتواند پیشبینی کند؟ ممکن است یک روز پزشک بهجای پنیسیلین، نسخهای از فاژ برای شما تجویز کند!
باکتریوفاژ درمانی (فاژ درمانی)
همانطور که گفته شد، باکتریوفاژ ها بهعنوان شکارچیان طبیعی باکتریها، از دیرباز بهعنوان عوامل درمانی بالقوه در نظر گرفته شدهاند. گزارشهای زیادی از فاژ درمانی استفاده شده در انسان وجود دارد. در یک مطالعه روی ۵۵۰ بیمار مبتلا به سپتیسمی باکتریایی (Bacterial septicemia)، فاژها بهصورت خوراکی، موضعی یا به چشم، گوش یا بینی تجویز شدند. میزان موفقیت برای درمان در این پروژه، از ۷۵ تا 100 درصد متغیر بود. اثربخشی در بیمارانی که به درمان آنتیبیوتیکی پاسخ نداده بودند حتی بیشتر بود.
فاژها همچنین برای موارد زیر مؤثر بودهاند:
- مننژیت مغزی نخاعی در عفونتهای پوستی نوزاد ناشی از سودوموناس، استافیلوکوک، کلبسیلا، پروتئوس و coli.
- آبسههای ساب فرنیک و زیر کبدی مکرر
- بیماریهای باکتریایی مزمن
فاژ درمانی همچنین برای عادیسازی سطح فاکتور نکروز تومور آلفا (TNF-α) در سرم یافت شده است.
جمعبندی
امید است که با مطالعه این مطلب به دانش مطلوبی از باکتریوفاژ ها و نقش آنها رسیده باشید. باکتریوفاژها که به نام فاژها نیز شناخته میشوند، ویروسهایی هستند که در باکتریها و آرکیها ایجاد عفونت کرده و تکثیر میشوند. این ویروسها از پروتئینهایی تشکیل شدهاند که ژنوم DNA یا RNA را محصور میکنند و میتوانند ساختارهای ساده یا پیچیدهای داشته باشند. باکتریوفاژ ها به طرز شگفتانگیزی در بیوسفر با تنوع و فراوانی وجود دارند و تخمین زده میشود که تعداد آنها از همه دیگر موجودات روی زمین بیشتر است. آنها با تزریق مواد ژنتیکی خود به سیتوپلاسم سلول میزبان در باکتریها تکثیر میشوند. باکتریوفاژ ها بهعنوان جایگزینی برای آنتیبیوتیکها در برخی مناطق مورداستفاده قرار گرفتهاند و بهعنوان درمانی در برابر سویههای باکتریایی مقاوم به چند دارو مورد بررسی قرار گرفتهاند. برهمکنش آنها با سیستم ایمنی از طریق بیان باکتریایی پروتئینهای کدگذاری شده با فاژ، تعامل فاژ – میزبان را به یک حوزه تحقیقاتی مهم تبدیل میکند.