ترنسفکشن | چیستی، تاریخچه، انواع، اهداف و روشهای انتقال
تصور کنید که میتوانید به دنیای میکروسکوپی سلولها سفر کنید، جایی که اطلاعات ژنتیکی بهعنوان نقشهای دقیق برای ساخت و کارکرد موجودات زنده عمل میکند. ترنسفکشن ، هنر و علم دستکاری این نقشههاست؛ روشی که به ما این امکان را میدهد تا ویژگیهای جدیدی را به موجودات زنده اضافه کنیم یا حتی بیماریها را درمان کنیم. در این مطلب، ما به بررسی روشهای مختلف انتقال ژن خواهیم پرداخت و خواهیم دید که چگونه این علم میتواند به تغییرات مثبت در زندگی ما منجر شود. با مجله بیوزوم همراه باشید تا با هم به دنیای جذاب انتقال ژن سفر کنیم و امکانات بیپایانی که در انتظار ماست را کشف کنیم.
ترانسفکشن (Transfection) به فرایندی اطلاق میشود که در آن اسیدهای نوکلئیک مانند DNA یا RNA و همچنین الیگونوکلئوتیدها، از طریق روشهای غیر ویروسی به سلولهای یوکاریوتی منتقل میشوند. با بهرهگیری از تکنیکهای فیزیکی و شیمیایی برای انتقال ژن، امکان بررسی عملکرد ژنها و بیان پروتئینها در محیط سلولی فراهم میشود. پیشرفت در سیستمهای گزارشگر ژنی و روشهای انتخابی برای حفظ پایداری و بیان DNA منتقل شده، کاربردهای ترانسفکشن را به طور قابلتوجهی گسترش داده است.
بیشتر بخوانید: پروتئین چیست به زبان ساده
اسیدهای نوکلئیک میتوانند با استفاده از مواد پلیمری یا لیپیدی که جذب سلولی را تسهیل میکنند، به داخل سلولها منتقل شوند. بهعنوانمثال اسیدهای نوکلئیک میتوانند با استفاده از لیپوزومها که ترکیباتی پلیمری هستند، به داخل سلولها منتقل شوند. این لیپوزومها به دلیل ساختار مشابه با غشای سلولی، بهراحتی میتوانند با غشای سلول ادغام شده و محتویات خود را وارد سیتوپلاسم کنند. در این فرایند، ابتدا لیپوزومها با اسیدنوکلئیک ترکیب شده و یک کمپلکس ترانسفکشن تشکیل میدهند. سپس این کمپلکسها از طریق اندوسیتوز به داخل سلول وارد میشوند. پس از ورود، کمپلکس در وزیکولهای اندوسیتوزی بستهبندی میشود و در نهایت، اسیدنوکلئیک آزاد شده و به سمت هسته سلول هدایت میشود تا بتواند عملکردهای ژنتیکی موردنظر را انجام دهد. این فرایند معمولاً برای مطالعات ژنومیک در آزمایشگاه (تحقیقات in vitro) مانند بررسی بیان ژن، غربالگری و مداخله RNA (RNA interference – RNAi) انجام میشود. همچنین در تحقیقات در محیط زنده (in vivo) بهمنظور تولید محصولات زیستی؛ مانند ویروسها و پروتئینها یا اهداف درمانی مورداستفاده قرار میگیرد.
در ادامه مطلب با روشهای مختلف انتقال اسیدهای نوکلئیک و پروتئینها به داخل سلول و مزایا و معایب هر یک آشنا میشویم.
تاریخچه ترنسفکشن (انتقال ژن)
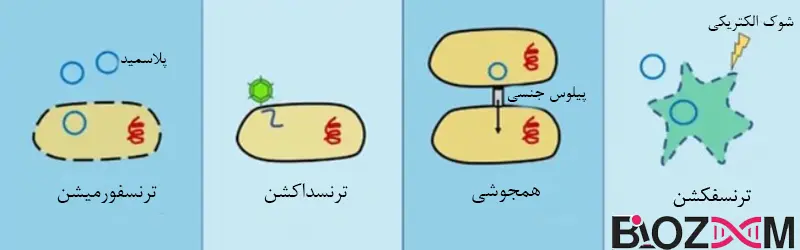
مفهوم انتقال ژن بین سلولها نخستینبار در باکتریها نشان داده شد که قادر به انجام حداقل چهار شکل طبیعی از تبادل ژنتیکی هستند. اولین مکانیزم در سال 1928 توسط فردریک گریفیت (Frederick Griffith) کشف شد و به عنوان “تبدیل” (Transformation) در باکتری استرپتوکوکوس پنومونیه (Streptococcus pneumoniae) نامگذاری شد. با این حال، او نتوانست ماهیت اصل تبدیل را مشخص کند
در سال 1944، اوزوالد آوری (Oswald Avery) مشخص کرد که ماده منتقل شده بین سلولها DNA است. شکل دوم انتقال ژن که “همجوشی” یا (Conjugation) نامیده میشود، در سال 1946 توسط جاشوا لدربرگ (Joshua Lederberg ) و ادوارد تاتوم ( Edward Tatum) در باکتری اشریشیا کلی کشف شد. این فرآیند شامل انتقال DNA از طریق یک پیوند مستقیم بین سلولهای باکتریایی بود. در اشریشیاکلی، این مجرای ارتباطی بین سلولها به شکل یک لوله پروتئینی به نام پیلیوس (Pilus) ظاهر میشود. توانایی سلولها برای ساخت پیلیوس و انتقال DNA از طریق آن بر روی یک پلاسمید بزرگ به نام عامل F (برای باروری) کدگذاری شده است.
در بیشتر موارد، عمل همجوشی شامل انتقال فقط پلاسمید بود که در سلول پذیرنده تثبیت میشد (نگهداری و حفظ پلاسمید در داخل سلول پذیرنده) و آن را از نوع F منفی به نوع Fمثبت تبدیل میکرد.
بااینحال، در برخی موارد، پلاسمید F میتواند به کروموزوم باکتری ادغام شود و این همجوشی منجر به انتقال ژنهای کروموزومی گردد. این فرایند که برای ایجاد اولین نقشه ژنتیکی اشریشیاکلی استفاده شد، با نام “القای جنسی” (sexduction) شناخته میشود. سپس در سال 1951، “ترانسداکشن” (transduction)، نوع جدیدی از انتقال ژن که توسط باکتریوفاژ انجام میشود، توسط جاشوا لدربرگ (Joshua Lederberg) و نورتون زیندر (Norton Zinder) در سالمونلا (Salmonella) کشف شد. آنها دریافتند که باکتریوفاژهای تازهتشکیلشده گاهی اوقات میتوانند مقداری از DNA سلول میزبان را بستهبندی کرده و سپس آن را در عفونت بعدی به سلول میزبان دوم منتقل کنند.
نکته: باکتریوفاژها (Bacteriophages) یا بهاختصار فاژها، ویروسهایی هستند که به باکتریها حمله کرده و آنها را آلوده میکنند. این اصطلاح از ترکیب دو واژه یونانی به معنای “باکتری” و “بلعیدن” تشکیل شده است. باکتریوفاژها به طور خاص برای آلودهکردن باکتریها طراحی شدهاند و نمیتوانند به سلولهای یوکاریوتی (مانند سلولهای انسانی) آسیب برسانند.
دو شکل ترانسداکشن شناسایی شد – ترانسداکشن عمومی (Generalized transduction) و ترانسداکشن تخصصی (Specialized transduction). در انتقال عمومی، باکتریوفاژ بهاشتباه تمام DNA سلول میزبان را در سرخود جای میدهد. درحالیکه در انتقال تخصصی، ژنوم فاژ در کروموزوم باکتریایی ادغام میشود و به DNA میزبان متصل میشود. مکانیسم چهارم انتقال ژن در باکتریها با همجوشی کامل سلولی انجام میشود و در چندین جنس از باکتریها از جمله باسیلوس و استرپتومایسس رخ میدهد. در شرایط طبیعی، کپسید ویروسی برای واردکردن انکوژن (یک ابزار کلیدی در تحقیقات سرطان و توسعه درمانهای جدید) و بقیه ژنوم به سلول میزبان حیوان موردنیاز است. فرایند غیرعادی انتقال ژن بدون کپسید ویروسی ترانسفکشن (Transfection) نامیده شد تا آن را از عفونت معمولی متمایز کند.
بیشتر بخوانید: علم ژنتیک
در ژنتیک باکتریایی، اصطلاح “تبدیل” (Transformation) همچنان برای توصیف جذب پلاسمید یا DNA ژنومی عاری از پوشش (بهطورکلی هر نوع DNA که پتانسیل تبدیل فنوتیپ سلول پذیرنده را داشته باشد) استفاده میشد، درحالیکه “ترانسفکشن” (Transfection) به طور خاص برای توصیف جذب DNA عاری از باکتریوفاژ یا RNA به کار میرفت، یعنی اسیدنوکلئیکی که پتانسیل آغاز یکچرخه تکثیر باکتریوفاژ را داشته باشد. اصطلاح “ترانسفکشن” بهطورکلی پذیرفته شد تا به معنای معرفی هر نوع DNAباکتریوفاژ، پلاسمید، ژنومی یا غیره، به داخل یک سلول حیوانی در غیاب یک ناقل بیولوژیکی باشد.
تکنیکهای مختلف ترنسفکشن
انتقال ژن به دو نوع ترنسفکشن موقتی (Transient) و پایدار (Stable) تقسیم میشود. در ترنسفکشن موقتی، DNA منتقلشده به کروموزوم میزبان ادغام نمیشود. DNA به یک سلول پذیرنده منتقل میشود تا سطح بالایی از بیان موقت ژن هدف را به دست آورد. در ترنسفکشن پایدار که به آن ترنسفکشن دائمی نیز گفته میشود، DNA منتقلشده به DNA کروموزومی وارد (ادغام) میشود و ژنتیک سلولهای پذیرنده به طور دائمی تغییر میکند. صرفنظر از روش تحویل، انتقال ژن به سلولهای حیوانی باید سه هدف مشخص را محقق کند:
اهداف انتقال ژن
- انتقال DNA: ابتدا، DNA خارجی باید از غشای سلولی عبور کند.
- آزادسازی مواد ژنتیکی: پس از عبور از غشای سلولی، ماده ژنتیکی باید درون سلول آزاد شده و به محل بیان یا فعالیت خود منتقل شود.
- فعالسازی ماده ژنتیکی: در مرحله نهایی انتقال ژن، ماده ژنتیکی خارجی باید فعال شود. این ماده باید از کمپلکس خود آزاد شده و برای بیان یا تعامل با ژنوم میزبان آماده شود. RNA خارجی تنها به طور موقتی در میزبان وجود دارد، درحالیکه DNA خارجی میتواند به طور موقتی یا دائمی وجود داشته باشد.
بیشتر بخوانید: ژن چیست؟ – به زبان ساده
دستهبندی روشهای انتقال ژن
روشهای انتقال ژن معمولاً شامل سه دسته هستند:
- ترنسفکشن با روشهای بیوشیمیایی (Transfection by biochemical methods)
- ترنسفکشن با روشهای فیزیکی (Transfection by physical methods)
- ترانسداکشن میانجیگری شده توسط ویروس (Virus-mediately transduction)
اولین پروتکلهای انتقال ژن از DNA عاری از پوشش استفاده کردند که با مواد شیمیایی خاصی مخلوط شده و کمپلکسهای مصنوعی تشکیل دادند. این کمپلکسهای مصنوعی یا با غشای سلولی تعامل کرده و جذب را از طریق اندوسیتوز ترویج میکنند یا با غشا ادغام شده و DNA را مستقیماً به سیتوپلاسم منتقل میکنند. چنین روشهای شیمیایی ترنسفکشن به طور گستردهای مورداستفاده قرار گرفتهاند؛ اما معمولاً برای انتقال ژن در شرایط زنده (in vivo) ناکارآمد هستند.
در مقابل، روشهای فیزیکی ترنسفکشن برای انتقال ژن هم در شرایط آزمایشگاهی (in vitro) و هم زنده (in vivo) مؤثر هستند. این روشها شامل شکستن غشای سلولی و معرفی اسیدنوکلئیک مستقیماً به داخل سلول یا هسته هستند. اگرچه هر دو مجموعه از این رویهها مزایا و معایبی دارند، برخی از مؤثرترین روشهای ترنسفکشن که امروزه استفاده میشوند شامل ترکیبی از فرایندهای شیمیایی و فیزیکی هستند. در ادامه با انواع روشهای انتقال فیزیکی و شیمیایی و همچنین روش انتقال توسط ویروس به طور مفصل آشنا میشویم.
بیشتر بخوانید: نوکلئیک اسیدها، رازداران حیات
ترنسفکشن شیمیایی سلولهای یوکاریوتی
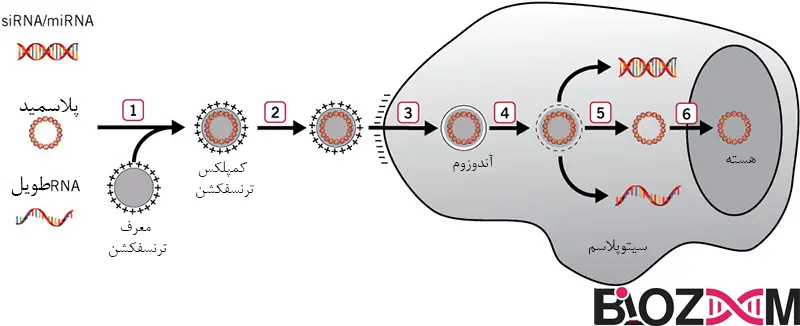
- معرف ترانسفکشن با اسید نوکلئیک ترکیب میشود تا مجتمعهای ترانسفکشن با بار مثبت تشکیل شود.
- کمپلکسها به سلولها اضافه میشوند و از طریق فعل و انفعالات الکترواستاتیکی به سطوح سلولی با بار منفی متصل میشوند.
- سلولها کمپلکسها را از طریق اندوسیتوز درون وزیکولهای غشایی به نام اندوزوم درونی میکنند.
- معرف ترانسفکشن غشای اندوزومی را بی ثبات میکند.
- کمپلکسها از اندوزوم ها فرار میکنند و محمولههای اسید نوکلئیک را در سیتوپلاسم آزاد میکنند (siRNA، miRNA یا RNA بزرگ عموماً در سیتوپلاسم فعال هستند).
- DNA باید در هسته، جایی که کاست بیان ژن رونویسی میشود، محلی شود.
انتقال فسفات کلسیم (Calcium phosphate Transfection)
روش ترنسفکشن با فسفات کلسیم اولین روش شیمیایی ترنسفکشن بود که با سلولهای حیوانی استفاده شد. فسفات کلسیم احتمالاً پرکاربردترین روش ترنسفکشن است. این یک روش ساده و قابلاعتماد است که برای بسیاری از ردههای سلولی کشتشده قابلاستفاده است و مواد موردنیاز آن ارزان هستند. این روش میتواند هم برای ترانسفورماسیون (تبدیل) موقتی و هم پایدار به کار رود.
اصول کار
اصل این تکنیک این است که DNA در یک محلول بافر فسفات بهآرامی با کلرید کلسیم مخلوط میشود که منجر به تشکیل یک رسوب نازک- DNA فسفات کلسیم میشود. این رسوب بر روی سلولها نشسته و برخی از ذرات آن از طریق اندوسیتوز جذب میشوند. مؤثرترین ترنسفکشن در سلولهایی که بهصورت لایهای رشد میکنند، اتفاق میافتد، زیرا این سلولها به طور یکنواخت با رسوب پوشانده میشوند.
تاریخچه
این روش در سال 1973 توسط گراهام (Graham) و ون در ارب (van der Erb) برای معرفی DNA آدنو ویروس (Adenovirus) به سلولهای رت توسعه یافت. در گزارشی که توسط سزیبالسکا (Szybalska) و سزیبالسکی (Szybalski) در سال 1962 منتشر شد، نشان داده شد که وجود کلسیم مسئول موفقیت تبدیل سلولهای انسانی با DNA ژنومی است. همچنین، اولین خطوط سلولی پستانداران که بهطور پایدار با DNA پلاسمیدی ترانسفکشن شده بودند، نیز در سال 1978 با استفاده از روش ترنسفکشن با فسفات کلسیم تولید شدند.
ترانسفکشن با DEAE-dextran (Transfection with DEAE-dextran)
DEAE-dextran اولین ماده ترنسفکشن بود که توسعه یافت و تا ظهور مواد لیپوفکشن (Lipofection) در دهه 1990 به طور گستردهای مورداستفاده قرار میگرفت. این یک کربوهیدرات پلی کاتیونی محلول است که از طریق تعاملات الکترواستاتیک با DNA تجمعاتی تشکیل میدهد. این ماده به کل کمپلکس بار مثبت خالص میدهد که به آن اجازه میدهد با غشای سلولی دارای بار منفی تعامل کند و جذب آن از طریق اندوسیتوز را ترویج دهد.
ویژگیها و مزایا
- کمپلکسهای کوچک: این کمپلکسها نسبت به ذراتی که در روش ترنسفکشن با فسفات کلسیم تشکیل میشوند، بسیار کوچکتر هستند.
- استفاده کمتر از :DNA همچنین در هر آزمایش ترنسفکشن میتوان مقدار کمتری DNA استفاده کرد.
- هزینه پایین: مانند روش فسفات کلسیم، مواد موردنیاز نیز ارزان هستند و فرایند ساده و مؤثر است.
محدودیتها
بااینحال، ترنسفکشن میانجیگری شده توسط DEAE-dextran به طور خاص برای تولید ردههای سلولی پایدار تغییریافته چندان کارآمد نیست. این بدان معناست که اگرچه این روش برای ترنسفکشن موقتی مؤثر است، اما در ایجاد تغییرات دائمی در ژنوم سلولها کارایی کمتری دارد.
لیپوفکشن (Lipofection)
انتقال ژن به کمک لیپوزومها برای اولینبار توسط فنگلر (Fengler) در سال 1980 توصیف شد. لیپوزومها برای تشکیل ذرات همجوشی با DNA استفاده میشوند. این ذرات، وزیکولهای فسفولیپیدی یکنواخت و آبگریز هستند. هنگامی که این وزیکولها با سلولها در کشت مخلوط میشوند، با غشای سلولی همجوشی کرده و DNA را مستقیماً به سیتوپلاسم منتقل میکنند. لیپوفکشن رایجترین روش انتقال ژن شیمیایی برای ژندرمانی است. یکی از معایب آن این است که آمادهسازی لیپوزومهای حاوی DNA پیچیده و زمانبر است. یکی از مزایای خاص این روش، توانایی تبدیل سلولهای موش در شرایط زنده از طریق تزریق لیپوزومها به ورید دم است (لیپوزومها ساختارهای میکروسکوپی کروی هستند که از لایههای فسفولیپیدی تشکیل شدهاند و میتوانند بهعنوان حاملهایی برای انتقال داروها، مواد مغذی و سایر ترکیبات استفاده شوند).
بیشتر بخوانید: غشای سلولی، دیواری قابل اعتماد
ترنسفکشن به کمک لیپوزوم، نخستین تکنیک غیر ویروسی است که به طور خاص برای انتقال DNA در شرایط زنده طراحی شده است. کارایی انتقال ژن به کمک لیپوزوم میتواند با گنجاندن پروتئینهای ویروسی که همجوشی فعال بین غشای ویروسی و غشای سلولی را تسهیل میکنند، افزایش یابد. این ذرات همجوشی بهعنوان ویروسومها (Virosomes) شناخته میشوند. لیپوفکشن برای ترانسفکشن گذرا و پایدار بسیار قابلتکرار و بسیار کارآمد است. این روش اجازه میدهد تا 90% از سلولها در کشت به طور موقت ترنسفکت شوند. همچنین کارایی ترنسفکشن پایدار را تا 20 برابر بیشتر از روشهای شیمیایی استاندارد نشان میدهد. یکی از معایب این رویکرد این است که معمولاً آمادهسازی لیپیدها در آزمایشگاه دشوار است و بنابراین باید از منابع تجاری خریداری شوند که بسیار گران هستند. معرفهای ترنسفکشن مبتنی بر لیپید شامل یک گروه سر مثبت، یک لینک کننده و یک “لنگر” آبگریز (“لنگر” به بخش آبگریز (غیرقطبی) مولکول اشاره دارد که به گروه سر مثبت و لینک کننده متصل است.) هستند. گروه سر معمولاً بین یک تا چهار گروه آمین دارد و این گروه یا از طریق پیوند گلیسرول به یک زنجیره هیدروکربنی آلیفاتیک متصل میشود یا از طریق انواع مختلف پیوندها به یک لنگر کلسترول متصل میشود.
انتقال فیزیکی (Physical Transfection)
در روشهای فیزیکی، DNA با استفاده از نوعی نیروی فیزیکی مستقیماً به سیتوپلاسم یا هسته منتقل میشود. هیچ نیازی برای تعامل با غشای پلاسمایی وجود ندارد. این امر از درگیری با مسیر اندوزومی جلوگیری میکند و در نتیجه میزان آسیب وارد شده توسط DNA اگزوژن را محدود میکند. روشهای ترانسفکشن فیزیکی معمولاً گران هستند و از نوعی دستگاه استفاده میکنند که برای اعمال نیروی فیزیکی لازم است. DNA ممکن است بهصورت آزاد در محلول وارد شود، اما ممکن است محافظت از آن با تشکیل کمپلکسهای شیمیایی (بهعنوانمثال با پلیآمینها (Polyamines)) برای کاهش اثرات مخرب نیروهای برشی در طول فرایند انتقال مفید باشد.
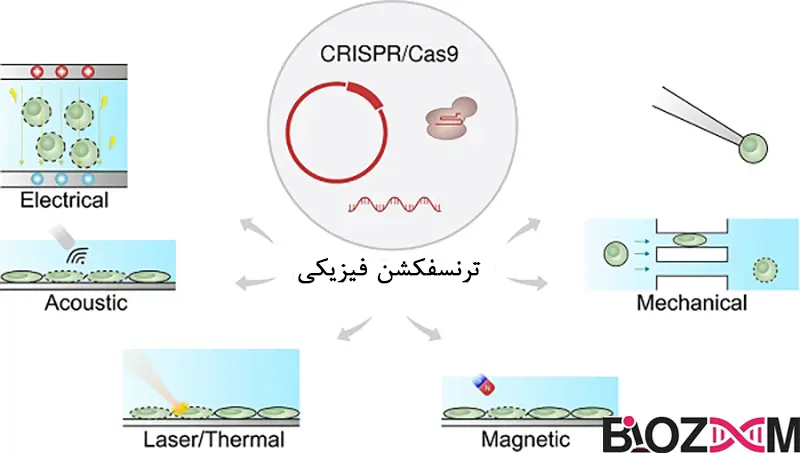
ترنسفکشن الکتروپوریشن (Electroporation)
این روش برای اولینبار توسط نیومن و همکارانش در سال 1982 با سلولهای حیوانی استفاده شد. الکتروپوریشن، ترنسفکشن سلولها پس از قرارگیری در معرض یک میدان الکتریکی پالسدار (متناوب) است. این امر باعث باز شدن تعدادی حفره به اندازه نانومتر در غشای پلاسمایی به مدت حداکثر 30 دقیقه میشود و اجازه میدهد DNA آزاد از محیط اطراف وارد سلول شود. پس از آن، حفرهها بهطور خودبهخود بسته میشوند و هیچ اثر منفی قابل توجهی بر روی سلولهای درمان شده ندارد. این روش برای بسیاری از خطوط سلولی تثبیت شده، به ویژه آنهایی که در برابر روشهای شیمیایی ترنسفکشن مقاوم هستند، ایدهآل است.
روش استاندارد الکتروپوریشن بسیار ساده است. سلولها در یک بافر الکتروپوریشن معلق یا غرق میشوند و سپس به یک پالس الکتریکی با ولتاژ بالا و کوتاهمدت قرار میگیرند. شدت و مدتزمان پالس، کارایی ترنسفکشن را تعیین میکند و این شرایط باید برای خطوط سلولی مختلف بهصورت تجربی تعیین شود. این روش کارآمد، بسیار تکرارپذیر و مناسب برای ترنسفکشن پایدار و موقتی است و مزیت اضافی آن این است که تعداد کپیهای ترانس ژن تا حدی قابلکنترل است.
معایب این تکنیک شامل نیاز به تجهیزات خاص تخلیه خازن است که قادر به کنترل دقیق طول پالس و ولتاژ باشد، نیاز به تعداد بیشتری از سلولها و غلظتهای بالاتر DNA نسبت به روشهای شیمیایی، و همچنین سطح نسبتاً بالای مرگ سلولی است که همراه با این فرایند وجود دارد.
بیشتر بخوانید: مرگ سلولی | چیستی، علل وقوع و انواع
الکتروپوریشن همچنین بهعنوان روشی برای انتقال ژن در شرایط زنده مورد بررسی قرار گرفته است. این روش با موفقیت برای معرفی DNA به بافتهای سطحی یا نزدیک به سطح مانند پوست، عضله و ملانوما، و همچنین به اندامهای داخلی مانند کبد استفاده شده است. در میان دستگاههای تجاری موجود برای الکتروپوریشن، حداقل یکی از آنها به طور خاص برای درمان ژنی مبتنی بر الکتروپوریشن در انسان طراحی شده است.
الکتروپوریشن در ابتدا فقط برای سلولهای کشتشده در حالت تعلیق قابلاستفاده بود، اما اکنون میتواند با سلولهایی که در لایههای تکسلولی رشد میکنند نیز استفاده شود. بهتازگی، یک اصلاحیه از این تکنیک به نام نوکلوفکشن (Nucleofection) توصیف شده است. این روش شرایط خاص الکتروپوریشن را با مواد ترنسفکشن مختلف ترکیب میکند تا انتقال مستقیم ژن از طریق الکتروپوریشن به هسته را تسهیل کند و منجر به ترنسفکشن کارآمد اهداف دشوار از جمله سلولهای اولیه شود. یک فناوری دیگر به نام لیزر پوریشن (Laser poration) نیز وجود دارد که بر اساس تشکیل حفرهها با استفاده از درمان لیزری عمل میکند. این روش مکانیزم مشابهی برای ورود DNA دارد؛ بدین معنا که DNA آزاد مستقیماً از محیط اطراف از طریق حفرههای موقتی ایجاد شده توسط پرتو لیزر متمرکز وارد سلول میشود. مانند میکرواینجکشن (Microinjection)، این استراتژی تنها میتواند بر روی تعداد کمی از سلولها در یکزمان اعمال شود، اما با غلظت مناسب DNA میتواند منجر به فرکانسهای ترنسفکشن پایدار بالای 0.5% شود.
میکرواینجکشن (Microinjection)
میکرواینجکشن مستقیم DNA به سیتوپلاسم یا هسته سلولهای کشت شده گاهی بهعنوان یک روش ترنسفکشن استفاده میشود. این روش در سطح سلولهای فردی بسیار کارآمد است. مهمترین کاربرد این تکنیک، معرفی DNA به اووسیتها، تخمها و جنینهای حیوانات است، چه برای تحلیل بیان موقتی مثال در ماهیها یا زنوپوس (یک جنس از قورباغهها) (Xenopus) و چه برای تولید حیوانات تراریخته (Transgenic) (مانند موشها و مگس سرکه). این روش زمانبر است و فقط تعداد کمی از سلولها میتوانند درمان شوند. در ابتدا، این تکنیک برای تبدیل سلولهایی که به روشهای دیگر ترنسفکشن مقاوم بودند، استفاده میشد. کارایی ترنسفکشن پایدار بسیار بالا است و به حدود 20% میرسد و مقادیر بسیار کمی از DNA کافی است. این تکنیک تحویل مستقیم DNA به هسته را فراهم میکند و از مسیر اندوژن جلوگیری کرده و همچنین اطمینان حاصل میکند که DNA به طور سالم منتقل میشود. میکرواینجکشن برای معرفی وکتورهای بزرگ مانند YACs به پرونوکلئوس (pronuclei) (پیش هسته) تخمهای بارور شده موش مناسب است. DNA که به این روش منتقل میشود باید بسیار خالص باشد، بنابراین نیاز به آمادهسازی زیادی دارد تا از fragmentation جلوگیری شود. شکستگی نیز ممکن است در سوزن تحویل رخ دهد و قطعات بزرگ DNA معمولاً با تعلیق در یک بافر با نمک بالا و یا مخلوطکردن با پلیآمینها و سایر عوامل حفاظتی محافظت میشوند. اکنون ترنسفکشن سلولهای کشت شده به طور خودکار با فرایندهای میکرو دستکاری و میکرواینجکشن کنترلشده توسط کامپیوتر انجام میشود، همچنین تولید خودکار مویرگهای تزریقی و استانداردسازی فرایند آمادهسازی سلول بهصورت خودکار انجام میشود.
ترنسفکشن با بمباران ذرات (Transfection by particle bombardment)
روش بمباران ذرات (که بهعنوان بیولستیک یا ترنسفکشن میکروپرتابه (Microprojectile) نیز شناخته میشود) شامل پوششدادن ذرات طلا یا تنگستن بهاندازه میکرومتر با DNA و سپس شتاب دادن این ذرات به سمت سلولها یا بافتها است. یکی از مزایای عمده این روش این است که DNA میتواند به عمق سلولها در برشهای بافتی منتقل شود و عمق نفوذ میتواند با تغییر نیروی اعمال شده تنظیم شود. اندازه و جرم کل ذرات و همچنین نیروی بمباران از جمله پارامترهای مهمی هستند که تعادل بین نفوذ کارآمد و آسیب به سلول را برقرار میکنند. این تکنیک برای تبدیل ذرت توسعه داده شد و اکنون یک روش انتخابی برای تولید گیاهان غلات تراریخته است. برای سلولهای حیوانی، این تکنیک کمتر مورداستفاده قرار گرفته است؛ زیرا معمولاً ترنسفکت کردن سلولهای کشت شده با روشهای جایگزین و تثبیت شده آسانتر است. بااینحال، این تکنیک در ترنسفکشن اندامهای کامل و برشهای بافتی نقش یافته است و بهتازگی برای انتقال DNA به اندامهای سطحی در ژندرمانی نیز مورداستفاده قرار گرفته است.
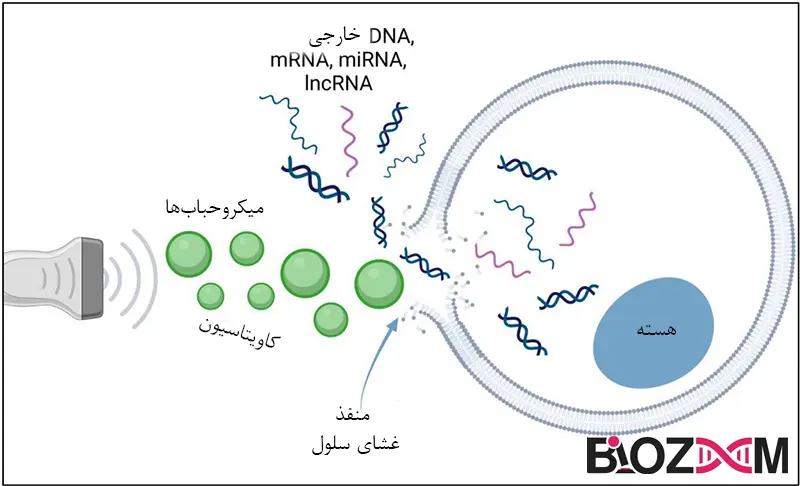
ترنسفکشن با اولتراسوند (Transfection by ultrasound)
این روش شامل قراردادن سلولها در معرض یک پروب نوسانی سریع، مانند نوک سونیکاتور (Sonicator) است. اعمال امواج اولتراسوند به ظرفی حاوی سلولها یا بافت خاصی منجر به تشکیل و فروپاشی حبابها در مایع میشود که این فرایند به نام کاویتاسیون (Cavitation) شناخته میشود. ظاهر موقتی چنین حفرههایی به DNA اجازه میدهد تا از غشای سلولی عبور کرده و به سیتوپلاسم وارد شود. تحقیقات نشان دادهاند که استفاده از اولتراسوند با فرکانس پایین امکان تحویل مؤثر اسیدهای نوکلئیک به سلولهای پستانداران را هم در شرایط آزمایشگاهی (in vitro) و هم در شرایط زنده (in vivo) فراهم میکند، زیرا DNA پلاسمیدی به طور ساختاری سالم باقی میماند. علاوه بر این، به نظر میرسد که امواج اولتراسوند هیچ اثر منفیای هنگام تمرکز بر مکانهای آناتومیکی مختلف در بدن انسان ندارند؛ بنابراین، تحویل ژن بهوسیله اولتراسوند نگرانیهای ایمنی ایجاد نمیکند. انتقال ژن در شرایط زنده معمولاً با تزریق و سپس استفاده از دستگاه اولتراسوند متمرکز انجام میشود.
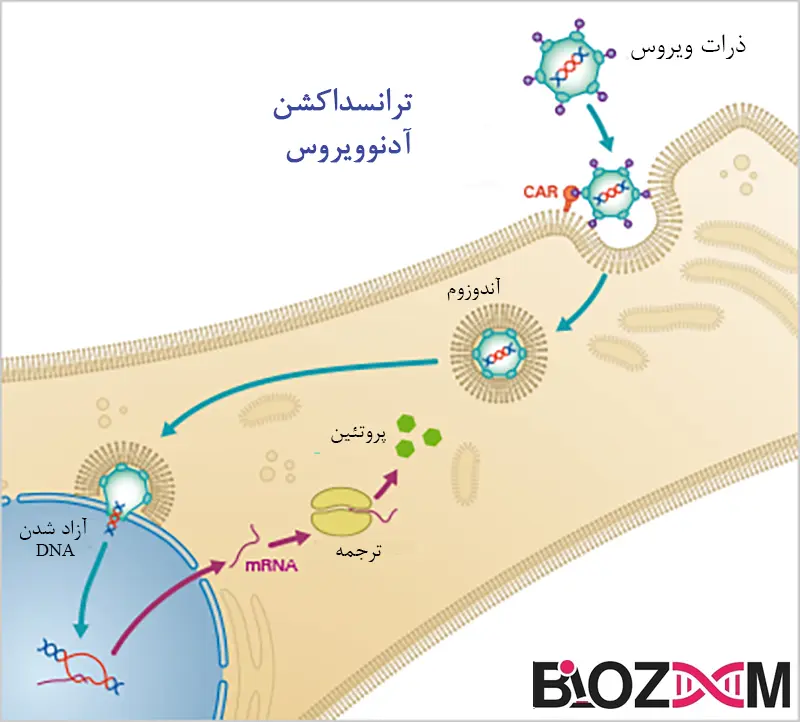
انتقال ژن بهوسیله ویروس (Virus-mediated transduction)
ویروسها بهگونهای تکامل یافتهاند که بتوانند اسیدهای نوکلئیک را به طور ایمن به سلولهای حیوانی منتقل کنند. ویروسهای پوششدار و غیر پوششدار روشهای متفاوتی برای تعامل با غشای سلولی دارند. در مورد ویروسهای پوششدار، آنها با اتصال به گیرندههای خاص بر روی سطح سلول، اسیدنوکلئیک را منتقل میکنند و سپس یا به طور مستقیم با غشای پلاسمایی همجوشی میکنند یا پس از ورود به سلول از طریق اندوسیتوز، با غشای اندوزومی همجوشی مییابند.
در مقابل، ویروسهای غیر پوششدار با استفاده از پروتئینهای خاص ویروسی به غشاهای پلاسمایی یا اندوزومی نفوذ میکنند یا آنها را تخریب میکنند. در هر دو حالت، ژنوم ویروسی در سیتوپلاسم آزاد شده و به محل طبیعی تکثیر خود منتقل میشود که ممکن است هسته باشد یا نباشد. انتقال اسیدنوکلئیک خارجی به سلولهای حیوانی بهعنوان بخشی از یکذره ویروسی ترکیبی، بهعنوان ترنسداکشن شناخته میشود. مزایای روشهای ترنسداکشن ویروسی نسبت به ترنسفکشن با DNA پلاسمیدی خالص شامل کارایی بالای انتقال ژن است، زیرا این روش فرایند تحویل طبیعی را دنبال میکند.
بیشتر بخوانید: ویروس چیست؟ مرز میان قلمرو زندهها و غیرزندهها
ویروسهای مختلف برای اهداف مختلف تبدیل استفاده میشوند:
- آدنوویروسها (Adenoviruses) برای عفونتهای کوتاهمدت با بیان موقتی بالا
- ویروسهای هرپس (Herpesviruses) برای بیان بلندمدت
- رتروویروسها (Retroviruses) برای ادغام پایدار DNA در ژنوم سلول میزبان
آدنوویروسها
آدنوویروسها، ویروسهای DNAدار بدون پوشش هستند که دارای کپسید بیستوجهی (Icosahedral) به قطر حدود 100 نانومتر و یک ژنوم خطی دو رشتهای 36 کیلوباز هستند. از دو جنس شناخته شده، تنها ماستادنورویروسها (Mastadenoviruses) میتوانند سلولهای پستانداران را آلوده کنند. شش زیرگروه از آدنوویروسهای انسانی بر اساس آزمایشهای آگلوتیناسیون سلولی و محتوای GC ژنومی تعریف شدهاند. مزایای عمده وکتورهای آدنو این است که میتوان آنها را تا تیترهای بسیار بالا خالص کرد که این امر آنها را برای کاربردهای in vivo بسیار مناسب میسازد و کارایی انتقال ژن نزدیک به 100% است اگر سلولهای هدف گیرندههای مناسب را داشته باشند.
آدنوویروسها بهعنوان حاملهایی برای انتقال آنتیژنهای مختلف به سلولهای میزبان استفاده میشوند. بهعنوانمثال، واکسنهایی که علیه ویروسهایی مانند HIV، ابولا و آنفلوانزا توسعه یافتهاند، از این ویروسها بهره میبرند. این واکسنها با قراردادن کاسِتهای تراریخته در ساختار آدنوویروسی تولید میشوند که قادر به ایجاد پاسخ ایمنی قوی و پایدار در بدن هستند
ویروسهای هرپس
ویروسهای هرپس، ویروسهای بزرگ پوششداری هستند که دارای ژنوم DNA خطی دو رشتهای با طولی بین 100 تا 200 کیلوباز هستند. ساختار ویریون یا ویروس شامل یک پوشش لیپیدی خارجی است که با تعداد زیادی گلیکوپروتئین و سایر پروتئینها پوشیده شده و اطراف یک ماتریس پروتئینی به نام تگومنت (Tegument) قرار دارد که بر روی کپسید اصلی قرار دارد. پیچیدگی پوشش لیپیدی باعث میشود که ویروسهای هرپس تنوع قابل توجهی در دامنه میزبان و تمایل سلولی نشان دهند. دو نوع ویروس هرپس که به عنوان وکتور توسعه یافتهاند، شامل ویروس اپشتین-بار ((EBV) (Epstein-Barr)) و ویروس هرپس سیمپلکس ((HSV1) Herpes simplex virus) هستند. ویروس EBV دامنه میزبان و تمایل بسیار محدودی دارد (محدوداً به لنفوسیتهای B انسانی و چند نوع سلول دیگر) و بنابراین چندان مفید نیست. اما ژنوم EBV پس از ترنسفکشن در بسیاری از سلولها تکثیر میشود و به عنوان یک رپلیکون اپیزومال (Episomal replicon) یا خارج از کروموزوم حفظ میشود. بنابراین، ژنوم EBV به عنوان پایهای برای مجموعهای از وکتورهای پلاسمیدی با ظرفیت بالا برای بیان ترانسژن اپیزومال در سلولهای انسانی استفاده شده است. در مقابل، HSV1 دامنه میزبان و تمایل بسیار وسیعی دارد و به عنوان یک وکتور ترنسداکشن چندمنظوره توسعه یافته است. پس از عفونت، ژنوم HSV در هسته سلول میزبان برای همیشه باقی میماند، یعنی دارای چرخه عفونت نهفته مادامالعمر است. مزایای دیگر HSV1 به عنوان یک وکتور شامل ظرفیت بالای آن برای DNA خارجی، عفونت مؤثر نورونها و توانایی ویروسهای دارای قابلیت تکثیر برای عبور از سیناپسها است. HSV–1 دارای دامنه میزبان گسترده و تمایل سلولی است زیرا گلیکوپروتئینهای C و B موجود در پوشش با گلیکوزامینوگلیکانهای موجود بر روی سطح سلول مانند هپاران سولفات و درماتان سولفات تعامل دارند.
محققان از HSV بهعنوان یک وکتور برای انتقال ژنهای درمانی به سلولهای عصبی استفاده میکنند. این رویکرد بهویژه در درمان بیماریهایی مانند بیماری هانتینگتون و بیماری زوال عقل موردتوجه قرار گرفته است. با استفاده از این ویروس، میتوان ژنهای معیوب را اصلاح یا جایگزین کرد و بهاینترتیب عملکرد طبیعی سلولها را بازیابی نمود.
بیشتر بخوانید: نگاهی بر بیماری هانتینگتون
رتروویروسها
رتروویروسها، ویروسهای RNAدار پوششداری هستند که شامل یک ویریون پروتئینی حدود 100 نانومتر قطر دارند که توسط یکلایه لیپیدی احاطه شده است. هر ذره ویروسی دو کپی از یک ژنوم RNA مثبت تکرشتهای را حمل کرده و همچنین چندین پروتئین موردنیاز برای عفونت را داراست. بر اساس دادههای مقایسه توالی، هفت جنس از رتروویروسها وجود دارد. آنکورتروویروسهای (Oncoretroviruses) معمولی، مانند ویروس لوسمی موشی (MLV) ساده هستند. درحالیکه لنتی ویروسها (Lentiviruses) مانند ویروس نقص ایمنی انسانی (HIV) و اسپوماویروسها (Spumaviruses) پیچیده هستند.
لنتیویروسها
لنتیویروسها حاوی ژنهای اضافی در مقایسه با ژنوم اصلی انکورتروویروس هستند. استراتژی تکثیر رتروویروسها منحصربهفرد است. پس از ورود به سلول، ویروس بدون پوشش شده و RNA ژنومی به هسته منتقل میشود و در آنجا به یک کپی cDNA دو رشتهای فوقالعاده توسط پروتئین ویریون رونوشت معکوس تبدیل میشود سپس یک پروتئین ویریون دوم، اینتگراز، این کپی cDNA را وارد ژنوم میزبان میکند. محدوده میزبان هر گونه رتروویروس توسط پروتئینهای موجود در پوشش لیپیدی تعیین میشود. برخی از رتروویروسها دامنه میزبان بسیار محدودی دارند درحالیکه برخی دیگر دارای دامنه میزبان گستردهای هستند، زیرا پروتئینهای پوششی با گیرندههای توزیع گستردهتر تعامل دارند.
جمعبندی
امید است بامطالعه این مطلب دانش مطلوبی از انتقال ژن به دست آورده باشید. بهطورکلی در این مطلب آموختیم که انتقال ژن یک فرایند کلیدی در علم زیستشناسی است که به ما این امکان را میدهد تا اطلاعات ژنتیکی را از یک سلول به سلول دیگر منتقل کنیم و ویژگیهای جدیدی را به موجودات زنده اضافه کنیم. این فرایند شامل روشهای مختلفی مانند ترنسفکشن شیمیایی، فیزیکی و ویروسی است که هر کدام مزایا و معایب خاص خود را دارند. از زمان کشف مکانیزمهای انتقال ژن در باکتریها، این علم به طور چشمگیری پیشرفت کرده و کاربردهای گستردهای در پزشکی، کشاورزی و تحقیقات علمی پیدا کرده است. با استفاده از تکنیکهای نوین، میتوانیم به درمان بیماریها، تولید محصولات زیستی و حتی اصلاح ویژگیهای گیاهان و جانوران بپردازیم. در نهایت، انتقال ژن نهتنها درک ما از زندگی را عمیقتر میکند؛ بلکه امکانات بیپایانی برای بهبود کیفیت زندگی انسانها فراهم میآورد.