
پروتئین چیست به زبان ساده
پروتئین مادهای است که سالهای سال ذهن دانشمندان زیادی را به خود مشغول کرده و دستاوردهای بسیار بزرگی را برای محققانِ خود به ارمغان آورده است. همانطور که از مطالب مربوط به آموزش زیست شناسی آموختیم، پروتئینها یکی از چهار گروه ماکرومولکولهای زیستی (درشت مولکولهای زیستی) هستند که متنوعترینِ آنها نیز به حساب میآیند. پروتئینها در نوع خود بسیار شگفتآور هستند به طوریکه کاربردهای آنان از سرعت بخشیدن به واکنشها تا انتقال پیام، نقشهای ساختاری و غیره میتواند متغیر باشد. نوع فعالیت هر پروتئین در وهلهی اول به ساختار فضایی آن پروتئین بستگی دارد و ساختار فضایی پروتئین هم به توالی آمینواسیدی آن وابسته است. در این مطلب قصد داریم تا با این ماکرومولکول خارقالعاده آشنایی بیشتری پیدا کنیم. پس در ادامه با مجلهی بیوزوم همراه باشید.
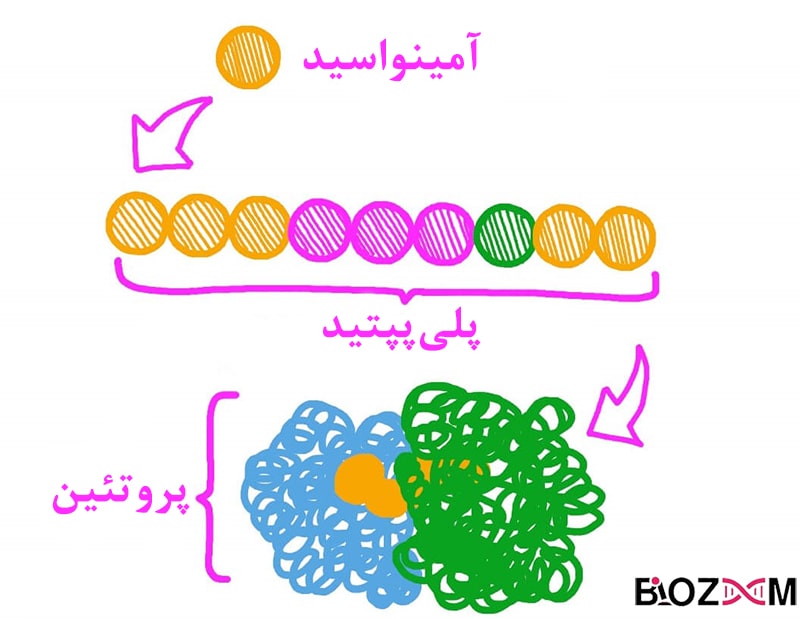
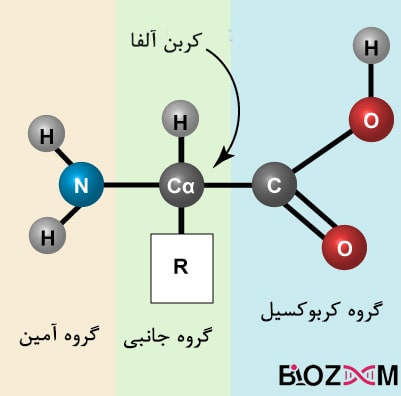
پروتئینها گروهی از ماکرومولکولهای تشکیلدهندهی دنیای زنده هستند و فعالیتهای حیاتی بدن مانند سرعت بخشیدن به واکنشها (نقش آنزیمی)، نقل و انتقال پیامهای شیمیایی درون خون (نقش هورمونی) و پشتیبانی ساختاری را بر عهده دارند. عمدهی پروتئینها، پلیمرهای خطیای میباشند که مونومرهای آنها متشکل از ۲۰ نوع آمینواسید مختلف هستند. تمامی این ۲۰ نوع آمینواسید ویژگیهای مشترکی دارند، از جمله داشتن یک گروه آمین (N-terminal) و کربوکسیلِ (C-terminal) متصل به یک کربن آلفا و یک زنجیرهی جانبیِ متغیر.
زنجیرههای جانبی آمینواسیدها از لحاظ ساختار و خواص شیمیایی با هم متفاوت بوده و این تفاوت نهایتاً منجر به اثرات متفاوت آمینواسیدها در ساختار پروتئین میشود. برایند اثرات زنجیرههای جانبی آمینواسیدها در ساختار پروتئین، ساختار سهبعدی و فعالیت پروتئین را مشخص میکند.
نحوهی اتصال آمینواسیدها به یکدیگر در زنجیرهی پلیپپتیدی، پیوند پپتیدی نام دارد. زمانیکه یک آمینواسید به ساختار پروتئین افزوده میشود، یک آمینواسید جداگانهی باقیمانده (residue) نام میگیرد، همچنین مجموعهی اتصالات اتمهای کربن، نیتروژن و اکسیژن با نام زنجیرهی اصلی (backbone) پروتئین شناخته میشود.
گاهشمار کشف پروتئینها
کشف پروتئینها وتمایز آنها از سایر ماکرومولکولها، در قرن هجدهم توسط فردی به نام آنتوان فورکروی (Antoine Fourcroy) و گروهی از دانشمندان دیگر انجام شد. این افراد پروتئینها را به عنوان گروهی از مولکولهای زیستی معرفی کردند که قادر به لخته شدن ومتراکم شدن تحت شرایط اسیدی یا حرارت، بودند. گفتنی است که آلبومین (پروتئین موجود در سفیدهی تخم مرغ)، پروتئینهای سرم خون و گلوتن گندم از جمله پروتئینهایی بودند که در آن زمان مورد توجه قرار گرفتند.
از آنجا که فرایند تخلیص و استخراج پروتئینها امری دشوار و طاقتفرسا برای بیوشیمیدانان بود، مطالعات اولیه بر روی پروتئینهایی انجام شد که در مقادیر بالا قابل استخراج و خالصسازی بودند؛ که از جملهی آنها میتوان به پروتئینهای خون، سفیده تخم مرغ، سموم مختلف و آنزیمهای گوارشی به دست آمده از دامها اشاره کرد.
شرکتی به نام «Armor Hot Dog» در دههی ۱۹۵۰، با استخراج یک کیلوگرم از ریبونوکلئاز A از لوزالمعدهی گاو، باعث شد تا ریبونوکلئاز A برای دهههای بعدی جز یکی از اهداف اصلی برای مطالعات بیوشیمیایی قرار گیرد.
نخستین پروتئینی که توالی آمینواسیدی آن به طور کامل مشخص شد، انسولین بود؛ این کار توسط فردریک سنگر در سال ۱۹۴۹ انجام شد. سنگر با این کار توانست ثابت کند پروتئینها از پلیمرهای خطی آمینواسیدی (زنجیرههای پلیپپتید) تشکیل شدهاند. او در سال ۱۹۵۸ موفق به دریافت جایزهی نوبل شد و روش طراحیشده توسط او به نام خودش به ثبت رسید.
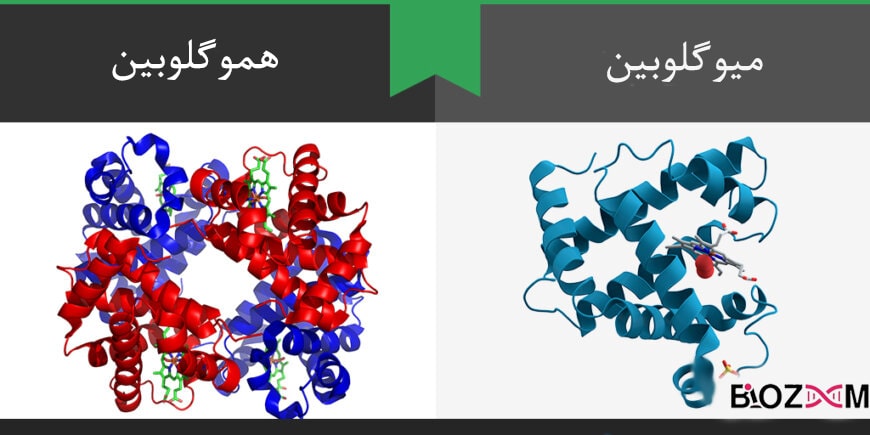
ساختار سهبعدی دو پروتئین هموگلوبین و میوگلوبین در سال ۱۹۵۸ به ترتیب توسط ماكس پروز و سر جان كودری كندرو شناخته شدند. این دو پروتئین نخستین پروتئینهایی بودند که ساختار سهبعدی آنها کشف شد. از آن زمان تا سال ۲۰۱۷، ساختار بیش از ۱۲۶۰۰۰ پروتئین با وضوح اتمی شناسایی شدهاست که اطلاعات مربوط به آن در بانک اطلاعات پروتئین موجود است. دو روش تعیین توالی پروتئینها در سطح اتمی شامل میکروسکوپ الکترونی کرایو (cryo-EM) برای ماکرومولکولها و پیشبینی ساختار پروتئینها برای دامینهای کوچک پروتئینی، هستند.
نقش پروتئینها در بدن
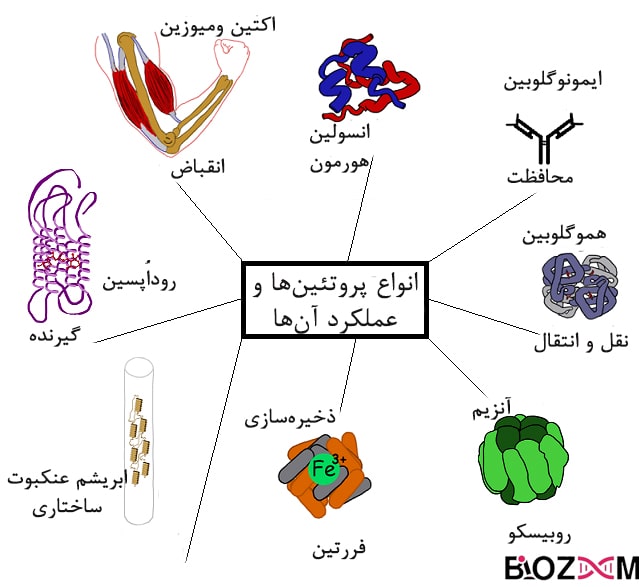
پروتئینها در موجودات زنده مسئولیت انجام عملکردهایی حیاتی را بر عهده دارند که باعث بروز ویژگیهای خاص موجود زنده میشوند. از جملهی این عملکردها میتوان به موارد زیر اشاره کرد:
- سرعت بخشیدن به واکنشهای بدن موجود زنده
- همانند سازی DNA
- پاسخ مناسب به محرکها
- نقش ساختاری در غشای سلولی
- نقل و انتقال مولکولها
- تنظیم فعالیتهای سلول
گفتنی است، پروتئینها با سایر مولکولها مانند پروتئینهای دیگر، لیپید ها، کربوهیدراتها و نوکلئیک اسید ها برهمکنش دارند.
غلظت پروتئینها در سلولهای گوناگون
تعداد پروتئینها در یک باکتری با اندازهی متوسط به طور تخمینی حدود دو میلیون برآورد میشود. در باکتریهایی با اندازهی کوچکتر مانند مایکوپلاسما و اسدیروشیتها، این عدد بین پنجاه هزار تا یک میلیون متغیر است. با این وجود در سلولهای یوکاریوتی به علت اندازه و پیچیدگی بیشتر، تعداد پروتئینها افزایش خواهد یافت. مثلاً سلولهای مخمر دارای پنجاه میلیون پروتئین بوده و سلولهای انسانی بین یک تا سه میلیارد پروتئین دارند.
یک سلول همهی پروتئینهایی را که کد ژنتیکی آنها در ژنوم سلول وجود دارد، تولید نمیکند، بلکه بسته به نوع عملکرد، محرکهای خارجی، آرایش پروتئینی سلول میتواند متفاوت باشد.
در یک سلول لنفوبلاستوئید به طور حدودی از بیست هزار پروتئینی که کد ژنتیکی آن درون ژنوم سلول موجود است فقط ۶۰۰۰ تای آنها توسط سلول بیان میشوند. به طورکلی میتوان گفت تعداد پروتينهایی که کد ژنتیکی آنها درون ژنوم موجود زنده وجود دارد با پیچیدگی ارگانیسم ارتباط دارد. برای مثال به طور متوسط یوکاریوتها ۱۵ هزار، باکتریها ۳۲۰۰، آرکیها ۲۴۰۰ و ویروسها ۴۲ عدد پروتئین دارند که کد ژنتیکی مربوط به آنها درون ژنوم این موجودات قرار دارد.
واحدهای سازندهی پروتئین
مونومریا واحد تشکیلدهندهی پروتئینها ، مولکولی به نام آمینواسید است. آمینواسیدها دارای زنجیرههای جانبیای هستند که در هر آمینواسید، این زنجیره متفاوت از آمینواسید دیگر است و این تفاوت در نهایت منجر به شکل گرفتن ساختار نهایی پروتئین در اثر برهمکنش این زنجیرهها با یکدیگر میشود.
این زنجیرههای جانبی خود، میتوانند دارای بار مثبت، منفی و یا خنثی باشند. آمینواسیدهایی که در ساختار پروتئینها حضور دارند، ۲۰ نوع هستند و آمینواسیدهای استاندارد نامیده میشوند. با این حال برخی از انواع غیر استاندارد در مولکولهای غیر پروتئینیِ گیاهان و قارچها قابل مشاهده هستند. برخی از این آمینواسیدهای غیر استاندارد، در اثر تغییر آمینواسیدهای استاندارد، پس از تولید پلیپپتید توسط ریبوزوم، به وجود میآیند.
پروتئینها چگونه سنتز میشوند؟
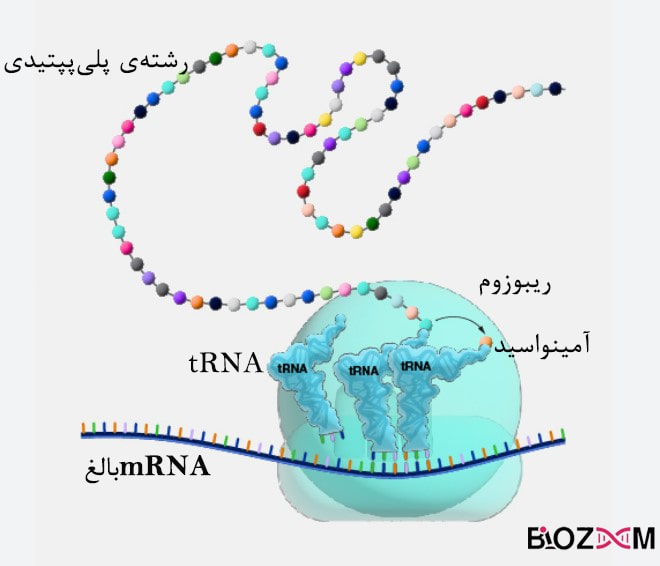
فرایندی به نام ترجمه مسئولیت تولید پروتئینها در موجودات زنده را بر عهده دارد؛ این فرایند در سیتوپلاسم انجام شده و طی آن رمزهای ژنتیکی که شامل سه نوکلئوتید(کدون) هستند به یک آمینواسید ترجمه میشوند. محل قرارگیری کدهای ژنتیکی DNA است که در آغاز فرایند توسط پروتئینهایی مانند RNA پلیمراز به RNA پیامرسان (mRNA) تبدیل میشوند، این تبدیل رونویسی نام دارد. پس از ایجاد RNA پیامرسانِ اولیه، تغییراتی روی این ماده انجام میشود که به mRNA بالغ تبدیل شده و سپس به عنوان الگویی برای سنتز پروتئین مورد استفاده قرار میگیرد.
ریبوزومها ساختارهای سلولیای هستند که کدهای RNA ها را به آمینواسید ترجمه میکنند و باعث اتصال آمینواسیدها به یکدیگر وایجاد رشتهی پلیپپتیدی میشوند. ترکیبهای سه نوکلئوتیدی میتوانند نمایندهی یک آمینواسید خاص باشند، مثلا AUG(آدنین – یوراسیل – گوانین) کد کنندهی آمینواسید متیونین است. با توجه به این نکته که DNA از چهار نوع نوکلئوتید متفاوت ساخته میشود، میتوان گفت تعداد ترکیبهای سه حرفی این نوکلئوتیدها ۶۴ عدد است و به این تعداد میتوانیم کدون متصور شویم. بنابراین برخی از آمینواسیدها بیش از یک کدون دارند و برای بعضی از کدونها آمینواسید متناظری وجود ندارد.
پروکاریوتها ممکن است mRNA را بدون هیچ تغییر و به محض تولید آن مورد استفاده قرار بدهند. اما در یوکاریوتها اینطور نیست و mRNA درون هستهی سلول تولید شده و سپس از طریق غشای هسته به سیتوپلاسم منتقل میشود. سرعت سنتز پروتئین در پروکاریوتها بیش از یوکاریوتها است و ممکن است به ۲۰ آمینواسید در ثانیه هم برسد.
مکانیسم کلی در ترجمه اینگونه است که mRNA روی ریبوزوم قرار گرفته و هر کدون با آنتیکدونی که بر روی یک tRNA قرار گرفته است منطبق میشود. آنزیمی به نام آمینواسیل tRNA سنتاز، باعث اتصال مولکولهای tRNA به آمینواسیدهای مناسب میشود. سنتز پروتئینها در موجودات زنده همواره از از انتهای N (آمین) به انتهای C (انتهای کربوکسیل) انجام میشود.
سنتز شیمیایی پروتئینها
پروتئینهای کوچک میتوانند با روشهایی موسوم به سنتز پپتیدی که بر پایهی تکنیکهای سنتز ارگانیک پپتیدها با بازده بالا هستند، تولید شوند. با این روش سنتز میتوان آمینواسیدهای غیر استاندارد را نیز به زنجیره اضافه کرد. مثلاً، اضافه کردن پروبهای فلوئورسنت به زنجیرههای جانبی آمینواسیدها به منظور شناسایی توالی آنها یکی از این روشها است.
این روشها استفادهی تجاری نداشته بلکه در آزمایشگاههای بیوشیمی و زیست سلولی استفاده میشوند. این نوع سنتز برای پلیپپتیدهایی با بیش از ۳۰۰ آمینواسید چندان کارآمد نیست و این پروتئینها ممکن است نتوانند به ساختار سوم طبیعی خود برسند. اغلب روشهای سنتز شیمیایی برخلاف واکنش طبیعی از انتهای کربوکسیل به سمت آمین به پیش میروند.
ساختار پروتئینها
بخش عمدهی پروتئینها پس از سنتز ساختارهای سهبعدی ویژهای پیدا میکنند که به عنوان ساختار طبیعی پروتئینها شناخته میشود. با اینکه بسیاری از پروتئینها به تنهایی و براساس خصوصیات آمینواسیدهایشان میتوانند ساختار سهبعدی منحصربهفرد خود را پیدا کنند، اما بعضی دیگر برای ایجاد فرم نهایی و عملکردی خود به کمک مولکولهایی به نام چپرونها (Chaperones) احتیاج دارند.
چپرونها پروتئینهایی هستند که عملکردهای متعددی دارند اما کارکرد اصلی آنها وصل شدن به پروتئینهای غیر بومی، ممانعت از تجمع غیراختصاصی آنها و کمک به ایجاد ساختار سهبعدی آنها است.
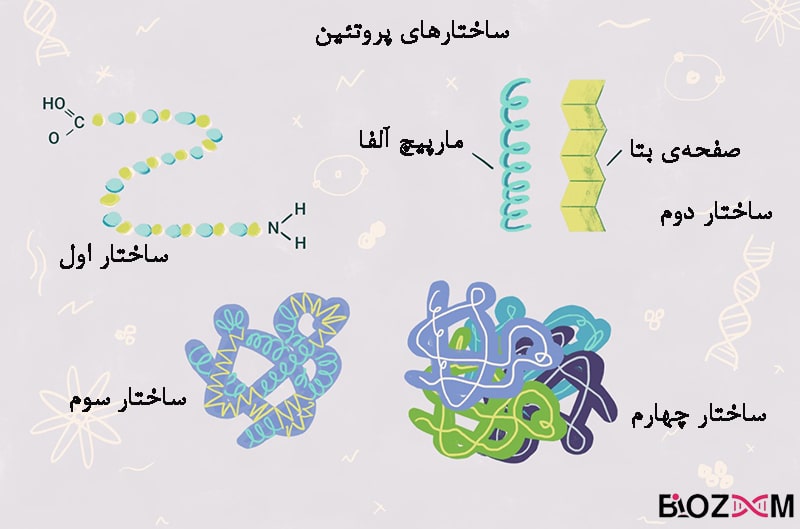
پروتئینها بر اساس میزان پیچیدگی و سازمانیابیشان، دارای ۴ ساختار هستند:
ساختار اول
این ساختار شامل توالی آمینواسیدی پروتئین است که به فرم یک پلی آمید یا پلیپپتید خطی است.
ساختار دوم
این ساختار به علت پیوندهای هیدروژنی و دی سولفیدی شکل میگیرد و شامل تکرار منظم ساختارهایی محلی است. متداولترین نمونههای این ساختار مارپیچ آلفا، صفحات بتا، turnها و لوپها هستند. به دلیل محلی بودن این ساختارها حضور مناطق مختلف با ساختار دوم متفاوت در یک مولکول پروتئین امری محتمل است.
ساختار سوم
این ساختار از کنار هم قرار گرفتن چندین ساختار دوم به وجود میآید و شکل کلی یک پروتئین را نمایش میدهد. این ساختار با انواعی از برهمکنشها تثبیت میشود که از جلمهی آنها میتوان به اتصالات آبگریز و آبدوست، پلهای نمکی، پیوندهای هیدروژنی، پیوندهای دیسولفیدی تثبیت میشود. عملکرد نهایی پروتئینها توسط این ساختار تعیین میشود.
ساختار چهارم
این ساختار فقط برای پروتئینهایی معنا دارد که شامل بیش از یک زنجیرهی پلیپپتیدی هستند و شامل کنار هم قرار گرفتن زیرواحدهای پروتئین کنار یکدیگر است.
پروتئینها مولکولهایی هستند که ساختار منعطفی دارند. علاوه بر سطوح ساختاری ذکر شده در بالا، پروتئینها قابلیت سازمانیابی در حالتهای مختلف در زمان انجام عملکردشان را نیز، دارند. ساختارهای سوم یا چهارمی که طی این عملکردها سازمان پیدا میکنند کانفورماسیون (Conformation) نام دارند و تغییر حالت بین کانفورماسیونها، تغییرات ساختاری نام دارد. این تغییرات ساختاری معمولاً با اتصال سوبسترا (پیشماده) به جایگاه فعال (بخشی از آنزیم که در کاتالیز واکنش مشارکت دارد) آنزیم به وجود میآیند.
تغییرات پس از ترجمهی پروتئینها
پس از ایجاد مولکول پروتئینی در سلول به طور معمول به آن گروههای عملکردی مانند قند یا فسفات اضافه میشود. این گروههای عملکردی ممکن است باعث به وجود آمدن عملکرد خاصی در پروتئین شوند. روشی که برای بررسی تغییرات ساختاری و عملکردی پروتئین به کار میرود استفاده از طیفسنجی جرمی است، در این روش میتوانیم سیگنالهای پروتئینی اصلاحشده و اصلاحنشده را مشاهده کنیم.
انواع تغییرات پس از ترجمه شامل موارد زیر هستند:
شکسته شدن پیوندهای پپتیدی
آنزیمهایی به نام پروتئازها به طور تخصصی، آمینو اسیدهای خاص در توالی پروتئین را تشخیص داده و پیوند پتیدی مربوطه را میشکنند و ساختار اولیه به طور برگشتناپذیر اصلاح میشود.
افزودن یا حذف کردن گروههای عملکردی به زنجیرههای جانبی آمینواسیدها
اصلاح زنجیرهی جانبی دارای مثالهای متعددی است اما موارد متداول آن شامل اکسیداسیون (oxidation)، آسیلاسیون (acylation)، گلیکوزیلاسیون (glycosylation)، متیلاسیون (methylation) و فسفوریلاسیون (phosphorylation) هستند.
هر دونوع تغییری که در بالا بیان شد، تقش مهاری و یا تحریکی بر عملکرد پروتئین یا آنزیم داشته و دارای نقش تنظیمی در سلول هستند.
انواع پروتئینها
پروتئینها بر اساس ساختار سومشان به سه گروه اصلی تقسیم میشوند:
پروتئینهای کروی
این گروه شامل بسیاری از آنزیمها بوده و تقریباً تمام پروتئینهای محلول جزء این دسته هستند.
پروتئینهای خطی
این دسته از پروتئینها اغلب نقش ساختاری دارند برای مثال میتوان از کلاژن نام برد که یکی از اجزای اصلی بافت پیوندی به شمار میرود و کراتین که در ناخن و مو حضور دارد.
پروتئینهای غشایی
این دسته از پروتئینها معمولاً به عنوان گیرنده یا کانالهایی برای عبور مولکولهای قطبی یا باردار از عرض غشا، فعالیت دارند.
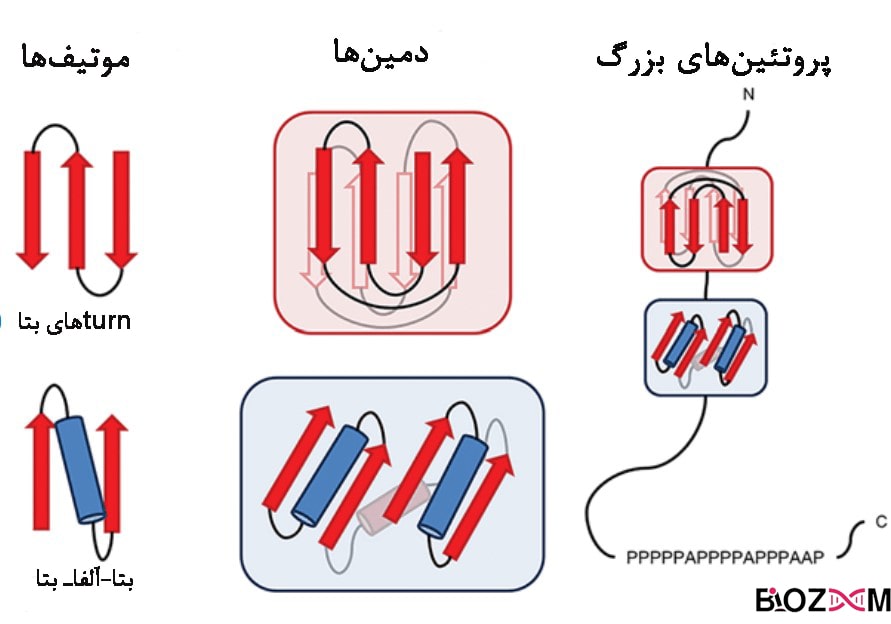
دامین پروتئین چیست؟
بخشهایی از ساختار سوم پروتئین که شامل بخشهای حفظشدهی پروتئین هستند و قادر به انجام عملکرد مستقل از سایر بخشها هستند را دامین پروتئین مینامند.
پروتئینها اغلب دارای چندین دامین اختصاصی هستند که هریک دارای عملکردی مخصوص به خود هستند و این دامینها ممکن است در خانوادهای از پروتئینها مشترک باشند. مثلاً دامین SH3 دارای ۶۰ جزء آمینواسیدی است که در پروتئینهای مختلفی از جمله مولکولهای فسفولیپاز و چندین تیروزین کیناز سیتوپلاسمی همچون ABL1 و تیروزین – پروتئین کیناز CSK، وجود دارد.
موتیف پروتئین چیست؟
توالیهای نه چندان بلند از آمینواسیدها در پروتئین، معمولاً عملکردی در جهت شناسایی پروتئینهای دیگر دارند. مثلاً دامینهای SH3 معمولاً به توالیهایی با چهار آمینواسید که در دو انتهای خود پرولین داشته باشند، متصل میشوند.
موتیفها در اصل ساختارهایی هستند که حدواسط ساختار دوم و سوم بوده و به عنوان ساختار فراثانویه نیز شناخته میشوند.
به این دلیل که تعیین ارتباط بین ساختار اول و سوم پروتئینها امری دشوار است، دو پلیپپتید ممکن است با وجود توالی آمینواسیدی متفاوت، دارای موتیف مشترک باشند. از طرفی، داشتن موتیف مشابه لزوماً حاکی از ساختار اولیهی متفاوت نیست.
موتیفها در اصل نمایندهی ارتباط میان عناصر ساختار دوم پروتئین هستند. موتیفها معمولاً شامل چند جزء هستند. مثلاً موتیف «مارپیچ – چرخش – مارپیچ» (helix-turn-helix) شامل سه جزء است.
با اینکه ممکن است ترتیب قرارگیری اجزای موتیف در همهی نمونههای آن یکسان باشد، اما امکان دارد ساختار اولیهی پروتئینِ (توالی پپتیدی) حامل موتیف یکسان نباشد و یا توالی ژن در آن ناحیهی DNA متفاوت باشد. موتیفهای ساختاری به طور معمول، علاوه بر ساختار ثانویه شامل حلقههایی با ساختار نامشخص و طول متغیرهستند.
موتیفهای ساختاری ممکن است شامل تکرارهای متوالی باشند که انواع رایج آنها را در ادامه بیان میکنیم.
سنجاق بتا (Beta hairpin): این موتیف شامل دو رشتهی بتای غیرموازی است که به وسیلهی چرخش چند آمینواسید، به هم متصل میشوند.
کلید یونانی (Greek key): این موتیف شامل چهار رشتهی بتا است که سه تای آنها با ساختار سنجاق سر به هم متصل هستند و رشتهی چهارم نیز در بالای آنها است.
لوپ امگا (Omega loop) : حلقهای است که اجزای آمینواسیدی ابتدا و انتهای آن بسیار به هم نزدیک هستند.
مارپیچ – لوپ- مارپیچ (Helix-loop-helix): این موتیف در عوامل رونویسی دیده میشود و متشکل از مارپیچهای آلفا است که توسط لوپهای آمینواسیدی به هم متصل میشوند.
انگشت روی (Zinc finger) : این موتیف شامل دو رشتهی بتا است که با انتهای یک مارپیچ آلفا روی هم جمع شدهاند. این ساختار در پروتئینهایی اتصالدهندهی DNA یافت میشوند.
مارپیچ – چرخش – مارپیچ (Helix-turn-helix) : این موتیف شامل دو مارپیچ آلفا است که با یک رشتهی کوتاه آمینواسیدی به هم متصل شدهاند. این ساختار، ساختاری متداول در پروتئینهای تنظیمکنندهی بیان ژن است.
Nest: سه جزء آمینواسیدی باعث ایجاد محلی برای اتصال آنیون میشوند.
Niche: سه یا چهار جزء آمینواسیدی متوالی باعث ایجاد محلی برای اتصال کاتیونها میشوند.
جمعبندی
با توجه به مطالب بیانشده واضح است که پروتئینها در بسیاری از عملکردهای سلول نقش داشته و فعالیتهای گستردهای را در موجودات زنده بر عهده دارند. این درشتمولکولها باعث تعیین ویژگیهای زیستی یک فرد میشوند، زیرا بیان ژنهای موجود زنده به شکل نمایهی (profile) پروتئینی سلولها بروز مییابد.
سوالات متداول
1- پروتئین چیست به زبان ساده؟
اگر بخواهیم که یک تعریف ساده از پروتئین داشته باشیم باید بدانیم که پروتئین یکی از 4 دستهی بیومولکولها (مولکولهای زیستی) بوده و از واحدهای کوچکی به نام آمینواسید ساخته میشود.
2- بیشترین پروتئین در چیست؟
بیشترین میزان پروتئین را میتوانیم در مواد غذایی همچون: آجیل و مغزها، لبنیات، گوشت قرمز و تخم مرغ پیدا کرده و با مصرف آنها، این منبع با ارزش را در اختیار بدنمان قرار دهیم.
3- پروتئین چیست در بدنسازی؟
یکی از مهمترین منابعی که در ورزشهای سنگین مانند بدنسازی باید حتما در رژیم غذایی ورزشکار وجود داشته باشد، پروتئین است که از با کیفیتترین و زود جذبترین نوع پروتئین میتوان به پروتئین آب پنیر یا همان وِی (Whey) اشاره کرد.




با سلام ببخشید یک سوالی داشتم مصرف روزانه ی پروتئین برای هر فرد چقدر است؟