پیوندهای شیمیایی | چیستی، انواع، ایجاد و اهمیت
پیوندهای شیمیایی اساس تمام فرایندهای زیستی را تشکیل میدهند و درک آنها برای علاقهمندان به زیستشناسی از اهمیت بالایی برخوردار است. این پیوندها نهتنها ساختار مولکولها را تعیین میکنند، بلکه در واکنشهای بیوشیمیایی و تعاملات سلولی نقش حیاتی دارند. از پیوندهای کووالانسی که مولکولهای پیچیدهای؛ مانند پروتئینها و DNA را میسازند، تا پیوندهای یونی و هیدروژنی که به پایداری ساختارهای زیستی کمک میکنند، هر نوع پیوند شیمیایی دنیای منحصربهفردی از تعاملات شیمیایی را نمایان میسازد. در این مطلب از مجله بیوزوم، به بررسی انواع پیوندهای شیمیایی پرکاربرد در زیستشناسی خواهیم پرداخت و اهمیت آنها را در درک بهتر فرایندهای زیستی توضیح خواهیم داد.
برخی از اتمها با بهدستآوردن یا ازدستدادن یک الکترون کامل (چندین الکترون) پایدارتر میشوند. هنگامی که اتمها این کار را انجام میدهند، یونها یا ذرات باردار به وجود میآورند. افزایش یا ازدستدادن الکترون میتواند به یک اتم، بیرونیترین لایه الکترونی پر شده بدهد و آن را از نظر انرژی پایدارتر کند.
تشکیل یون
یونها دو نوع هستند. کاتیونها (Cations) یونهای مثبتی هستند که با ازدستدادن الکترونها تشکیل میشوند. بهعنوانمثال، یک اتم سدیم یک الکترون را از دست میدهد تا به کاتیون سدیم (Na+) تبدیل شود.
یونهای منفی با دریافت الکترون تشکیل میشوند و آنیون (Anions) نامیده میشوند. نامگذاری آنیونها با پسوند “-اید” (“-ide”) انجام میشود: بهعنوانمثال، آنیون کلر (Cl–)، کلرید (Chlorine) نامیده میشود.
زمانی که یک اتم الکترونی را از دست میدهد و اتم دیگری آن الکترون را دریافت میکند، این فرایند را انتقال الکترون مینامند. یک نمونه از این فرایند، انتقال الکترون بین اتمهای سدیم و کلر است.
سدیم (Na) فقط یک الکترون در لایه الکترونی بیرونی خود دارد، بنابراین برای سدیم راحتتر (از نظر انرژی مطلوبتر) است که آن یک الکترون را اهدا کند تا یافتن هفت الکترون بیشتر برای پر کردن لایه بیرونی. به همین دلیل، سدیم تمایل دارد یک الکترون خود را از دست بدهد و Na+ را تشکیل دهد.
از طرف دیگر کلر (Cl) دارای هفت الکترون در لایه بیرونی خود است. در این حالت، بهدستآوردن یک الکترون برای کلر آسانتر ازدستدادن هفت الکترون است، بنابراین تمایل دارد یک الکترون بگیرد و به Cl– تبدیل شود.
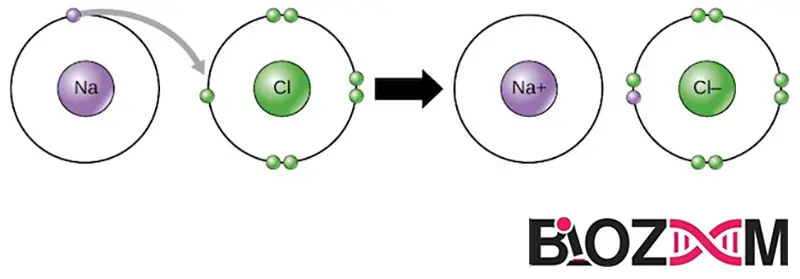
ایجاد پیوند یونی
پیوند یونی یکی از انواع پیوندهای شیمیایی است که بین یونهایی با بارهای مخالف تشکیل میشود. بهعنوانمثال، یونهای سدیم با بار مثبت و یونهای کلرید با بار منفی یکدیگر را جذب میکنند تا کلرید سدیم یا نمک خوراکی بسازند. نمک سفره، مانند بسیاری از ترکیبات یونی، فقط از یک یون سدیم و یک یون کلرید تشکیل نشده است. در عوض، حاوی یونهای زیادی است که در یک الگوی سهبعدی تکرارشونده و قابلپیشبینی (یک کریستال) مرتب شدهاند.
یونهای خاصی در فیزیولوژی بهعنوان الکترولیت (از جمله سدیم، پتاسیم و کلسیم) نامیده میشوند. این یونها برای هدایت تکانههای عصبی، انقباضات ماهیچهای و تعادل آب ضروری هستند. بسیاری از نوشیدنیهای ورزشی و مکملهای غذایی این یونها را برای جایگزینی یونهایی که از طریق تعریق در طول ورزش از بدن خارج میشوند، فراهم میکنند.
پیوند کووالانسی (Covalent Bonds)
پیوند کووالانسی، یکی دیگر از انواع پیوندهای شیمیایی است. برخلاف پیوندهای یونی که از جاذبه بین بار مثبت کاتیون و بار منفی آنیون تشکیل میشوند، مولکولهایی که توسط پیوند کووالانسی تشکیل میشوند، الکترونها را در یک رابطه پایدار متقابل به اشتراک میگذارند. مانند همسایههای کناری که فرزندانشان ابتدا در یکی از خانهها و سپس در خانه دیگر بازی میکنند، اتمها برای همیشه الکترون از دست نمیدهند یا به دست نمیآورند. در عوض، الکترونها بین عناصر به جلو و عقب حرکت میکنند. به دلیل اشتراک نزدیک جفتهای الکترون (یک الکترون از هر دو اتم)، پیوندهای کووالانسی قویتر از پیوندهای یونی هستند.
پیوندهای کووالانسی غیرقطبی (Nonpolar Covalent Bonds)
شکل 2 چندین نوع رایج پیوند کووالانسی را نشان میدهد. توجه داشته باشید که دو اتم با پیوند کووالانسی معمولاً فقط یک یا دو جفت الکترون به اشتراک میگذارند، اگرچه اشتراکهای بزرگتر ممکن است. مفهوم مهمی که باید از این موضوع برداشت شود این است که در پیوندهای کووالانسی، الکترونها در بیرونیترین لایه ظرفیتی به اشتراک گذاشته میشوند تا لایههای ظرفیت هر دو اتم را پر کنند و در نهایت هر دو اتم درگیر را تثبیت کنند. در پیوند کووالانسی تک، یک الکترون منفرد بین دو اتم مشترک است، در حالی که در پیوند کووالانسی دوتایی، دو جفت الکترون بین دو اتم مشترک است. حتی پیوندهای کووالانسی سهگانه وجود دارد که در آن سهاتم مشترک هستند.
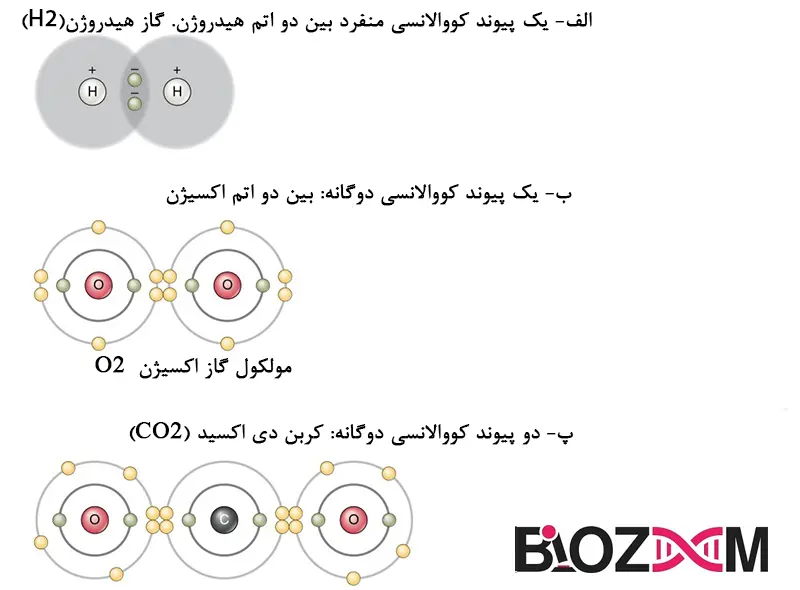
میبینید که پیوندهای کووالانسی نشاندادهشده در شکل 2 متعادل هستند. اشتراک الکترونهای منفی، همانند کشش الکتریکی پروتونهای مثبت در هستهاتم های درگیر، نسبتاً برابر است. به همین دلیل است که مولکولهایی که پیوند کووالانسی آنها تعادل الکتریکی دارند، غیرقطبی توصیف میشوند. یعنی هیچ ناحیهای از مولکول مثبت یا منفیتر از مناطق دیگر نیست.
پیوندهای کووالانسی قطبی (Polar Covalent Bonds)
در تعریف واژه قطبی باید بگوییم، گروههایی از قانونگذاران با دیدگاههای کاملاً متضاد در مورد یک موضوع خاص، اغلب توسط نویسندگان اخبار بهعنوان “قطبی” توصیف میشوند. در شیمی، مولکول قطبی به مولکولی اطلاق میشود که شامل مناطقی است که بارهای الکتریکی مخالف دارند. مولکولهای قطبی زمانی شکل میگیرند که اتمها الکترونها را به طور نابرابر در پیوندهای کووالانسی قطبی به اشتراک میگذارند.
آشناترین مثال از یک مولکول قطبی آب است (شکل 3). این مولکول دارای سه بخش است: یک اتم اکسیژن (O) که هسته آن دارای هشت پروتون است و دو اتم هیدروژن (H) که هر یک از هستههای آنها فقط یک پروتون دارد. از آنجا که هر پروتون بار مثبت یکسانی اعمال میکند، هستهای که دارای هشت پروتون است، باری هشت برابر بیشتر از هستهای که دارای یک پروتون است، اعمال میکند. این بدان معناست که الکترونهای با بار منفی موجود در مولکول آب، به شدت به سمت هسته اکسیژن جذب میشوند تا هستههای هیدروژن. بنابراین تک الکترون منفی هر اتم هیدروژن به سمت اتم اکسیژن مهاجرت میکند و انتهای اکسیژن پیوند آنها کمی منفیتر از انتهای هیدروژن پیوند آنها میشود.
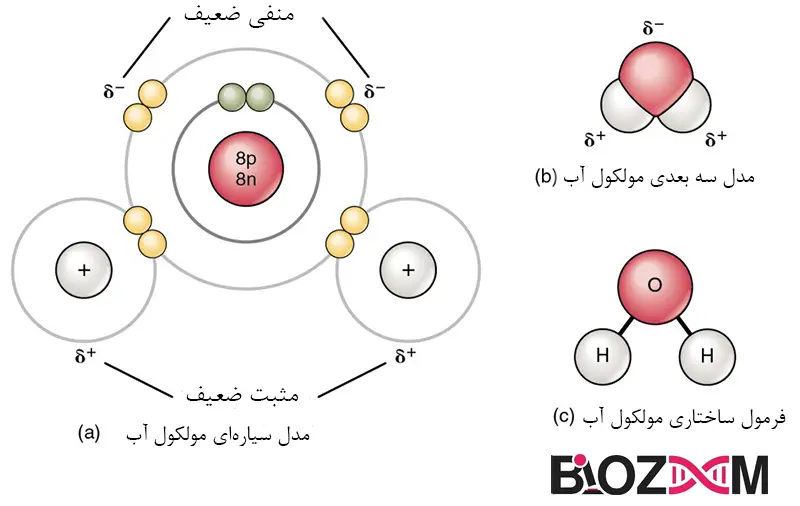
آنچه برای پیوندهای شیمیایی صادق است برای مولکول آب بهعنوان یک کل صادق است. یعنی ناحیه اکسیژن دارای بار کمی منفی و نواحی اتمهای هیدروژن دارای بار کمی مثبت است. این بارها اغلب بهعنوان “بارهای جزئی” یا بارهای ضعیف نامیده میشوند؛ زیرا قدرت بار کمتر از یک الکترون کامل است، همانطور که در یک پیوند یونی رخ میدهد. همانطور که در شکل 3 نشان داده شده است، مناطق قطبی ضعیف با حرف یونانی دلتا (∂) و علامت مثبت (+) یا منفی (-) نشان داده شدهاند.
حتی اگر یک مولکول آب به طور غیرقابلتصوری کوچک است، جرم دارد و بارهای الکتریکی مخالف روی مولکول آن جرم را بهگونهای میکشد که شکلی شبیه یک چادر مثلثی ایجاد میکند (شکل 3b را ببینید). این دوقطبی که بارهای مثبت در یک انتها بهوسیله اتمهای هیدروژن در “پایین” چادر و بار منفی در انتهای مقابل (اتم اکسیژن در “بالای” چادر) تشکیل میشود، احتمال تعامل مناطق باردار با دیگر مولکولهای قطبی را افزایش میدهد. در فیزیولوژی انسان، پیوند حاصل یکی از مهمترین پیوندهایی است که توسط آب تشکیل میشود: پیوند هیدروژنی. این پیوند به دلیل قدرت بالای خود و تأثیرش بر ساختار و عملکرد مولکولهای بیولوژیکی، نقش کلیدی در فرایندهای زیستی ایفا میکند.
پیوند هیدروژنی (Hydrogen bond)
پیوند هیدروژنی، یکی از انواع پیوندهای شیمیایی ثانویه در مولکولهای بیولوژیکی است. پیوند هیدروژنی قویترین پیوند ثانویه است که استحکامی تقریباً برابر با پیوندهای کووالانسی دارد.
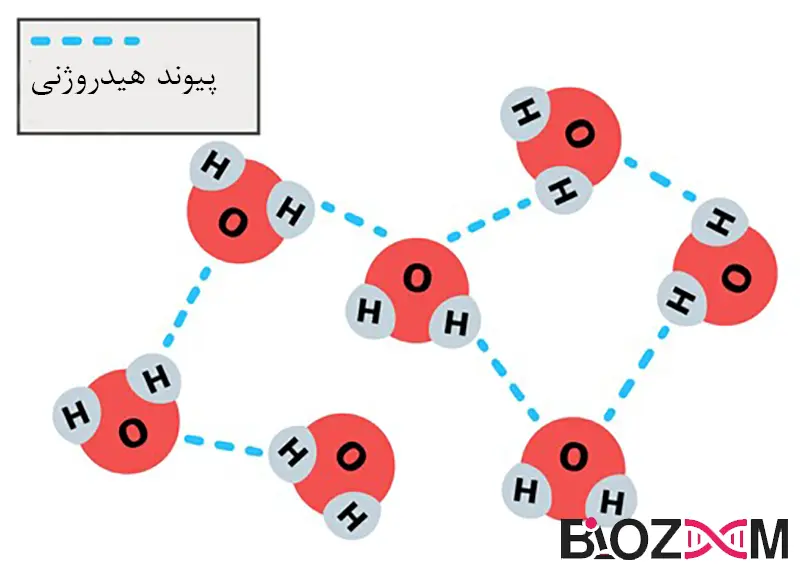
تشکیل پیوند هیدروژنی
پیوند هیدروژنی بین یک اتم هیدروژن و یک اتم بسیار الکترونگاتیو مانند اکسیژن یا نیتروژن تشکیل میشود. هنگامی که یک اتم هیدروژن در میل الکترونی یک اتم بسیار الکترونگاتیو مانند اکسیژن یا نیتروژن قرار میگیرد، نیروهای جاذبه الکترواستاتیکی بین پروتون هیدروژن و جفت تک الکترونهای اکسیژن یا نیتروژن وجود دارد.
تعداد پیوندهای هیدروژنی تشکیل شده توسط یک اتم الکترونگاتیو به تعداد الکترونهای آزاد موجود در بیرونیترین لایه آن بستگی دارد. اکسیژن دارای دو الکترون آزاد است و بنابراین میتواند دو پیوند هیدروژنی ایجاد کند درحالیکه نیتروژن به دلیل یک الکترون آزاد تنها یک پیوند هیدروژنی تشکیل میدهد.
اهمیت پیوند هیدروژنی
پیوند هیدروژنی در مولکولهای بیولوژیکی بسیار مهم است. به نکات زیر دقت کنید.
- مولکولهای آب از طریق پیوند هیدروژنی در کنار هم نگه داشته میشوند.
- ساختار ثانویه پروتئینها یعنی ورقههای آلفا مارپیچ و بتا از طریق پیوند هیدروژنی بین اجزای پیوند پپتیدی حفظ میشود.
- پیوند هیدروژنی همچنین ساختار سوم پروتئینها را حفظ میکند.
- مارپیچ دوگانه DNA از طریق پیوند هیدروژنی در بین بازهای نوکلئوتیدهای آن به هم متصل میشود.
- پیچخوردن زنجیره RNA روی خود از طریق پیوند هیدروژنی انجام میشود.
خلاصهای از انواع پیوندهای شیمیایی
پیوندهای شیمیایی نیروهای جاذبهای هستند که اتمهای مختلف را کنار هم نگه میدارند تا مولکولها تشکیل شوند.
مولکولهای بیولوژیکی دارای دو نوع پیوند اولیه و ثانویه هستند.
پیوند شیمیایی اولیه نیروهای جاذبه دائمی هستند که برای به هم پیوستن اتمها یا مولکولها برای تشکیل مولکولهای بیولوژیکی بزرگتر موردنیاز هستند. پیوندهای اولیه مهم در مولکولهای بیولوژیکی عبارتاند از:
- پیوندهای گلیکوزیدی، قندها را به یکدیگر یا ترکیبات غیر کربوهیدراتی در کربوهیدراتهای پیچیده، قندهای آمینه و نوکلئوتیدها مرتبط میکنند.
- پیوندهای پپتیدی، اسیدهای آمینه را در پروتئینها، پپتونها و سایر پلیپپتیدها به یکدیگر متصل میکنند.
- پیوندهای استری، الکل را با اسید متصل میکنند. آنها در لیپیدهایی مانند تری گلیسیرید مهم هستند.
- پیوندهای فسفودیاستر، نوکلئوتیدها را در اسیدهاینوکلئیک و دیگر پلینوکلئوتیدها به هم متصل میکنند.
پیوندهای شیمیایی ثانویه نیروهای جاذبه موقت بین مولکولها یا اتمها هستند. آنها برای حفظ ساختارهای پیچیده مولکولهای بیولوژیکی ضروری هستند. اینها عبارتاند از؛
- پیوندهای هیدروژنی، در پروتئینها و اسیدهای نوکلئیک مهم هستند
- فعلوانفعالات هیدروفوبیک، ساختار پروتئین سوم و چهارم را حفظ میکنند
- پلهای دی سولفیدی، این پیوندهای کووالانسی هستند که در ساختار پروتئین سوم و تاخوردگی پروتئین نقش دارند.
- بر همکنش یونی، جزو گروههای باردار هستند و در ساختار پروتئین سوم و چینخوردگی نقش دارند.
جمعبندی
امید است با ارائه این مطلب از مجله بیوزوم به درک شما از انواع پیوندهای شیمیایی مهم در زیستشناسی کمک کرده باشیم. به طور خلاصه میتوان گفت پیوندهای شیمیایی، شامل پیوندهای یونی و کووالانسی، نقش اساسی در ساختار و عملکرد مولکولهای زیستی دارند. یونها با ازدستدادن یا بهدستآوردن الکترونها تشکیل میشوند و میتوانند به کاتیونهای مثبت یا آنیونهای منفی تقسیم شوند. این یونها از طریق پیوندهای یونی که بر اساس جاذبه بین بارهای مخالف شکل میگیرند، با یکدیگر ترکیب میشوند. در مقابل، پیوندهای کووالانسی با اشتراک الکترونها بین اتمها ایجاد میشوند و به دو نوع غیرقطبی و قطبی تقسیم میشوند؛ در پیوندهای غیرقطبی، الکترونها به طور یکنواخت توزیع میشوند، درحالیکه در پیوندهای قطبی، توزیع نابرابر الکترونها باعث ایجاد نواحی باردار مثبت و منفی میشود. همچنین، پیوندهای هیدروژنی بهعنوان پیوندهای ثانویه، ارتباطات مهمی را بین مولکولها برقرار کرده و در پایداری ساختارهای پیچیدهای؛ مانند پروتئینها و DNA نقش دارند. در مجموع، این پیوندها برای فهم فرایندهای بیوشیمیایی و تعاملات سلولی ضروری هستند.