بیوشیمی آنزیم | چیستی، ساختار، بیوشیمی، فعالیتها و تقسیمبندی
آنزیمها به عنوان کاتالیزورهای غیرآلی، ترکیباتی هستند که میتوانند سرعت واکنشهای شیمیایی را تا دهها برابر افزایش دهند. این افزایش سرعت واکنشها نقش حیاتی در واکنشهای طبیعی و بقا سلولها دارد؛ بنابراین، حضور آنها برای بدن حیاتی و ضروری است. در عدم حضور آنزیمها، واکنشها به قدری آهسته انجام میشوند که کارایی لازم را ندارند. اکثر آنزیمها از جنس پروتئین هستند و برخی از ریبوزومها هم به عنوان کاتالیزور عمل میکنند.
در ادامه با مجله بیوزوم همراه باشید تا بیشتر با آنزیمها، بیوشیمی آنزیم، ساختار و عملکرد آنها آشنا شویم.
علم مطالعهی واکنشهای آنزیمی در بدن موجودات را بیوشیمی آنزیم مینامیم. برای بررسی مشکلات بدن، برخی از آنزیمها در خون یا سرم بدن آنالیز میشوند؛ اما برای مطالعه این واکنشها لازم است ابتدا آنزیمها و بیوشیمی آنزیم بیشتر شناخته شوند. بیشتر آنزیمها از جنس پروتئینی هستند، اما برخی از آنزیمهایی از جنس مولکول RNA نیز وجود دارند که به آنها ریبوزوم میگویند. در هر سلول، هزاران آنزیم وجود دارد که واکنشهای آن را تسریع میکنند.
کاتالیزور چیست؟
در حالتی که تمام شروط انجام یک واکنش، مانند دما، غلظت واکنشدهندهها و فشار اتمسفر ثابت باشد، مولکول A به مولکول B پیوسته و مولکول A-B را به وجود میآورد. سرعت این واکنش ثابت بوده و بهعنوان مثال ۳ مولکول A-B تنها در یک ثانیه ایجاد میشوند.
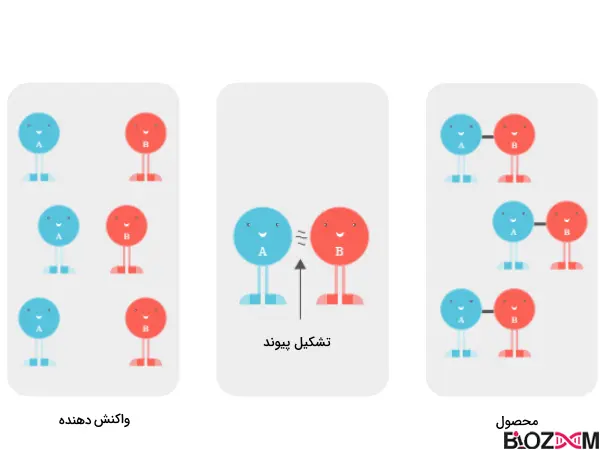
در حالتی که کاتالیزور به واکنش اضافه شود، سرعت آن افزایشیافته و در همان بازه زمانی، بهجای ۳ مولکول A-B دوازده مولکول A-B تولید میگردد. علاوه بر این، کاتالیزور بدون تغییر باقیمانده، در واکنش مصرف نشده است و همچنان در محیط حضور دارد.
یکی از ویژگیهای مهم کاتالیزور مصرف نشدن آن در واکنش است. بهعنوان مثال اگر روی شعله آتش بنزین ریخته شود، سرعت واکنش بالا میرود؛ ولی از آنجایی که بنزین در این واکنش مصرف شده، نقش کاتالیزوری ندارد.
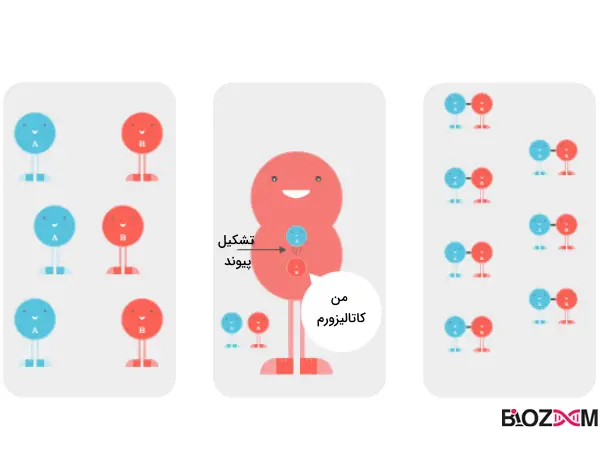
آنزیمها یک مثال رایج از کاتالیزورها هستند که سرعت واکنشها را بدون مصرفشدن در واکنشهای درون بدن افزایش میدهند. به همین دلیل مطالعه بیوشیمی آنزیم ها و شناخت نحوه عملکرد آنها دارای اهمیت است.
کاتالیزور یا آنزیم چگونه کار میکنند؟
همانطور که میدانید، نمیتوان قطبهای همنام آهنربا را به یکدیگر نزدیک کرد. برقراری پیوندهای شیمیایی نیز به همین ترتیب است؛ اتمها تنها در صورتی که از سمت مناسب به یکدیگر نزدیک شوند، یکدیگر را جذب میکنند.
حالا بگذارید به یک مثال توجه کنیم: فرض کنید مولکولهای نیتروژن اکسید (Nitrous oxide) در یک بطری قرار گرفتهاند. اگر بطری تکان داده شود، مولکولها با یکدیگر برخورد میکنند، اما تعداد مولکولهای N2 و O2 تولید شده بسیار کم است.
مانند مثال آهنربا، اگر اتم اکسیژن آهنربای قرمز و اتم نیتروژن آهنربای آبی فرض شود، این آهنرباها دو رفتار از خود نشان میدهند:
- آهنربای آبی و آهنربای قرمز یکدیگر را جذب میکنند.
- آهنرباهای همرنگ قویتر بوده و بیشتر یکدیگر را جذب میکنند.
در این مثال، اتم اکسیژن که با نیتروژن پیوند دارد، نزدیک یک مولکول اکسیژن – نیتروژن دیگر میشود، اما ترجیح اتمهای اکسیژن این است که بجای مولکول نیتروژن به یکدیگر متصل شوند، در نتیجه بهقدری محکم با هم برخورد دارند که پیوندشان با نیتروژن از بین رفته و به هم میپیوندند؛ بنابراین اگر مولکولها در جهتگیری مناسب و کنار هم قرار گیرند، مولکولهای اکسیژن تشکیل مولکول O2 را میدهند.
در این زمان، کاتالیزور یا آنزیم وارد عمل میشود. آنزیمها باعث میشوند مولکولها به طور مناسب در کنار هم قرار گرفته و با یکدیگر وارد واکنش شوند.
آنزیم چیست؟
آنزیم، مادهای است که بهعنوان یک کاتالیزور در موجودات زنده عمل کرده و سرعت انجام واکنشهای شیمیایی را بدون اینکه خودش در این فرایند تغییر کند، تنظیم میکند.
فرایندهای بیولوژیکی که در همه موجودات زنده رخ میدهد، واکنشهای شیمیایی بوده و بیشتر توسط آنزیمها تنظیم میشوند. بدون آنزیمها، بسیاری از این واکنشها با سرعت محسوسی انجام نمیشوند. آنزیمها تمام جنبههای متابولیسم سلولی را کاتالیز میکنند که شامل هضم غذا (تجزیه مولکولهای بزرگ مواد مغذی مانند پروتئینها، کربوهیدراتها و چربیها به مولکولهای کوچکتر)، حفظ و تبدیل انرژی شیمیایی و ساخت ماکرومولکولهای سلولی از پیشسازهای کوچکتر است. بسیاری از بیماریهای ارثی انسان، مانند آلبینیسم (Albinism) و فنیل کتونوریا (Phenylketonuria)، ناشی از کمبود یک آنزیم خاص است.
آنزیمها همچنین کاربردهای صنعتی و پزشکی ارزشمندی دارند. تخمیر شراب، خمیر کردن نان، تولید پنیر و آبجو از زمانهای قدیم انجام میشد، اما تا قرن نوزدهم این واکنشها نتیجه فعالیت کاتالیزوری آنزیمها شناخته نشده بود. از آن زمان، آنزیمها اهمیت فزایندهای در فرایندهای صنعتی که شامل واکنشهای شیمیایی آلی هستند، پیدا کردند. کاربرد آنزیمها در پزشکی شامل کشتن میکروارگانیسمهای بیماریزا، بهبود زخم و تشخیص بیماریهای خاص است.
ساختار آنزیم
آنزیمهای پروتئینی مانند سایر پروتئینها از اسیدهای آمینه ساخته شده و دارای ساختار اول، دوم و سوم هستند.
ساختار اول: آمینواسیدها با پیوند پپتیدی به شکل یک زنجیره به یکدیگر اتصال یافته و ساختار اولیه آنزیم را تشکیل میدهند. این زنجیره یک پلیپپتید است که چگونگی اتصال آمینواسیدهای آن توسط DNA کدگذاری شده است.
ساختار دوم: در هر آمینواسید، اتم هیدروژن گروه آمین و اتم اکسیژن گروه کربوکسیل در یک زنجیره پلیپپتید میتوانند با پیوند هیدروژنی به یکدیگر اتصال یابند. در این حالت پلیپپتید روی خود پیچخورده و ساختارهای دوم آلفا هلیکس (α- helix) و بتا شیت (β-sheet) را ایجاد میکند.
ساختار سوم: بعد از تشکیل ساختارهای دوم، زنجیره پلیپپتیدی بیشتر پیچخورده و ساختار سوم که دارای شکل سهبعدی است را ایجاد میکند.
عوامل مؤثر بر فعالیت آنزیمها
از آنجایی که آنزیمها در واکنشهایی که کاتالیز میکنند مصرف نشده و میتوانند بارها و بارها مورد استفاده قرار گیرند، تنها مقدار بسیار کمی از یک آنزیم برای کاتالیز یک واکنش مورد نیاز است. یک مولکول آنزیمی معمولی میتواند ۱۰۰۰ مولکول سوبسترا را در ثانیه تبدیل به محصول کند.
سرعت یک واکنش آنزیمی با افزایش غلظت سوبسترا افزایش مییابد و زمانی که تمام جایگاههای فعال مولکولهای آنزیم درگیر هستند به حداکثر سرعت میرسد. سپس گفته میشود که آنزیم اشباع شده است. سرعت واکنش با سرعتی که جایگاههای فعال میتوانند سوبسترا را به محصول تبدیل کنند تعیین میشود.
فعالیت آنزیم را میتوان به روشهای مختلفی مهار کرد:
- مهار رقابتی: مهار رقابتی زمانی اتفاق میافتد که مولکولهای بسیار شبیه به مولکولهای سوبسترا به جایگاه فعال متصل شده و از اتصال سوبسترای واقعی جلوگیری میکنند. بهعنوان مثال، پنیسیلین یک مهارکننده رقابتی است که جایگاه فعال آنزیمی را که بسیاری از باکتریها برای ساختن دیواره سلولی خود از آن استفاده میکنند، مسدود میکند.
- مهار غیررقابتی: مهار غیررقابتی زمانی اتفاق میافتد که یک مهارکننده در مکانی غیر از جایگاه فعال به آنزیم متصل شود. در برخی موارد مهار غیررقابتی، تصور میشود که مهارکننده بهگونهای به آنزیم متصل میشود که به طور فیزیکی جایگاه فعال طبیعی را مسدود میکند. در موارد دیگر، اعتقاد بر این است که اتصال بازدارنده شکل مولکول آنزیم را تغییر میدهد، در نتیجه جایگاه فعال آن تغییر شکل مییابد و از واکنش آن با سوبسترا خود جلوگیری میکند. این نوع اخیر از بازداری غیررقابتی، مهار آلوستریک نامیده میشود. محل اتصال بازدارنده به آنزیم جایگاه آلوستریک نامیده میشود.
کنترل آلوستریک میتواند شامل تحریک عمل آنزیم و همچنین مهار آن شود. یک مولکول فعالکننده میتواند به یک جایگاه آلوستریک متصل شده و با تغییر شکل آن واکنشی را در جایگاه فعال القا کند که سوبسترای آن به خودی خود نمیتواند این تغییر را ایجاد کند.
تحریک و مهار آلوستریک اجازه تولید انرژی و مواد توسط سلول را در صورت نیاز میدهد و تولید را در زمانی که عرضه انرژی کافی باشد مهار میکند.
بیوشیمی آنزیم ها و انرژی فعالسازی
انرژی لازم برای شروع واکنش را انرژی فعالسازی مینامند. آنزیمها باعث کاهش انرژی فعالسازی واکنش، با قراردادن مولکولهای واکنشدهنده در وضعیت مناسب میشوند.
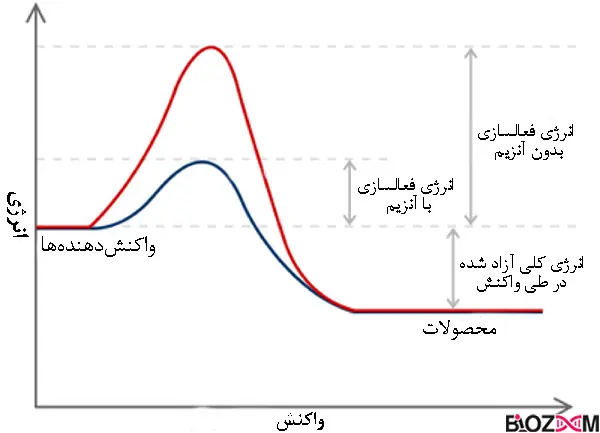
حالت گذار (Transition state) وضعیتی است که واکنشدهندهها انرژی زیادی داشته و ناپایدار هستند. واکنشدهندهها برای ورود به واکنش ابتدا به حالت گذار میرسند. رسیدن به حالت گذار برای انجام واکنش ضروری بوده و این کار به انرژی اولیه نیاز دارد. آنزیمها در این مرحله وارد شده و انرژی لازم برای رسیدن به حالت گذار را کاهش میدهند.
بیوشیمی آنزیم ها و جایگاه فعال
همانطور که میدانید قسمتی از آنزیم که واکنشدهندهها به آن اتصال مییابند، جایگاه فعال آنزیم نام دارد و به واکنشدهندهای که به آنزیم متصل میشود، سوبسترا آنزیم میگویند.
بیشتر آنزیمها پروتئینی بوده و از زیر واحدهای آمینواسید تشکیل شدهاند. پیچوتاب خوردن این آمینواسیدها، شکل سهبعدی خاصی به آنزیم میدهد. عملکرد و شکل جایگاه فعال آنزیم را، آمینواسیدهای موجود در این جایگاه مشخص میکنند. بهعنوان مثال زنجیره جانبی یک آمینواسید میتواند بازی، اسیدی، آبدوست یا آبگریز باشد و سوبسترا میتواند با پیوندهای غیرکووالانسی به جایگاه فعال آنزیم اتصال یابد.
پیوندهای غیرکووالانسی مانند:
پیوند الکترواستاتیک: آمینواسیدهای دارای زنجیره جانبی با بار الکتریکی میتوانند با سوبسترایی که بار مخالف داشته باشد، پیوند الکترواستاتیک دهند.
پیوند هیدروژنی: گروه آمین و کربوکسیل آمینواسید با سوبسترا پیوند هیدروژنی برقرار میکنند.
پیوند واندروالس: آمینواسیدهای دارای زنجیره جانبی قطبی غیرباردار با سوبسترا پیوند واندروالسی میدهند.
پیوند هیدروفوب یا آبگریز: آمینواسیدهای دارای زنجیره جانبی آبگریز میتوانند با سوبسترا پیوند هیدروفوب بدهند.
تقسیمبندی بر اساس بیوشیمی آنزیم ها
به طور کلاسیک برای نامگذاری آنزیمها از روشهای متفاوتی استفاده میشود. در یکی از این روشها از اسم سوبسترای آنزیم بهعلاوه آز (ase) در انتهای کلمه استفاده میکنند. بهعنوان مثال فوماراز آنزیمی است که فومارات را به مالات تبدیل میکند.
در روش دیگر از ماهیت آنزیمها برای نامگذاری استفاده میکنند. بهعنوان مثال تجزیه هیدروژن پراکسید را کاتالاز انجام میدهد که نام آن ربطی به سوبسترای آن ندارد. در کنار این استثناهایی هم وجود دارد، مثلاً تریپسین آنزیمی است که نوعی پروتئین را تجزیه میکند.
دانشمندان در سال ۱۹۶۴ میلادی، با توجه به یکسان نبودن روشی برای نامگذاری آنزیمها، سیستمی برای طبقهبندی آنها ابداع کردند. این سیستم، عدد کمیسیون آنزیمها (EC Number) نام گرفت که هر آنزیم دارای یک کد چهاررقمی اختصاص است.
برای مثال آنزیمی با عدد EC 3.4.11.4 به شکل زیر تعریف میگردد.
۳: عدد اول کلاس اصلی آنزیم را نشان میدهد که هیدرولاز (Hydrolase) است.
۴: عدد دوم نشاندهنده زیرگروه آنزیم است. ۴ به معنی پیوند پپتیدی است. یعنی این آنزیم پیوند پپتیدی را هیدرولیز میکند.
۱۱: عدد سوم نشاندهنده زیر – زیرگروه است. ۱۱، محل برش آنزیم که N ترمینال آمینواسید است را نشان میدهد.
۴: عدد چهارم شمارهسریال میباشد. ۴ به معنی برشدادن N ترمینال آمینواسید از تریپپتید است.
طبق این کدها میتوان نوع عملکرد و بیوشیمی آنزیم ها را متوجه شد.
بر اساس این سیستم، تقسیم آنزیمها به ۷ کلاس اصلی صورت میگیرد که در جدول زیر نشان داده شده است:
| EC.1 | اکسیدوردکتاز (Oxidoreductases) |
| EC.2 | ترنسفراز (Transferases) |
| EC.3 | هیدرولاز (Hydrolases) |
| EC.4 | لیاز (lyase) |
| EC.5 | ایزومراز (Isomerases) |
| EC.6 | لیگاز (ligases) |
| EC.7 | ترنسلوکاز (Translocase) |
تنظیم آنزیم
سلولهای بدن انسانها میتوانند تعداد زیاد و متنوعی از آنزیم را بسازند؛ ولی همه این آنزیمها بهصورت همزمان با هم کار نمیکنند. سلولها از مکانیسمهای متنوعی برای تنظیم عملکرد آنزیمها بهره میبرند.
مولکولهای تنظیمکننده: مولکولهای مهارکننده و فعالکنندهای توسط تولید میشوند که با آنها فعالیت آنزیم تنظیم میگردد.
کوفاکتورها (Co-Factors): فعالیت بسیاری از آنزیمها فقط زمانی اتفاق میافتد که مولکولی غیرپروتئینی به نام کوفاکتور به آنها اتصال یابد. مثالی از این کوفاکتورها یونهای مس، پتاسیم و روی هستند.
بستهبندیکردن: برخی از آنزیمها درون سلول تولید شده و داخل بستهبندی خاصی در سلول نگهداری میشوند بهعنوان مثال، آنزیمهای لیزوزومی درون اندامک لیزوزوم بستهبندی میشوند تا وارد سیتوپلاسم نشده و سلول را هضم نکنند.
مهار بازخوردی: در مهار بازخوردی، محصول حاصل از واکنش بهعنوان مهارکننده عمل کرده و جلوی فعالیت یک آنزیم در مسیر را میگیرد. بهعنوان مثال زمانی که تعداد زیادی ATP در سلول وجود دارد، آنزیمی که در تولید آن (ATP) ایفای نقش میکند را مهار کرده تا ATP اضافی تولید نگردد
دما: دما میزان فعالیت آنزیمی را کنترل میکند. البته هر آنزیمی میتواند دمای خاصی را تحمل کند و در آن دما دارای بهترین عملکرد است (دمای بهینه). دمای بالاتر از دمای بهینه باعث تغییر شکل آنزیم شده و سوبسترا توانایی اتصال به جایگاه فعال را از دست میدهد، در نتیجه فعالیت آنزیم کاهشیافته و واکنش انجام نمیشود
pH: زنجیره جانبی اسیدآمینههای موجود در جایگاه فعال میتوانند خنثی، اسیدی یا بازی باشند. اگر pH محیط آنها دچار تغییر شود، این زنجیرهها هم تغییر کرده و فعالیت آنزیم کاهش مییابد.
مدلهای فعالیت آنزیمها
دو مدل اصلی عمل آنزیم وجود دارد:
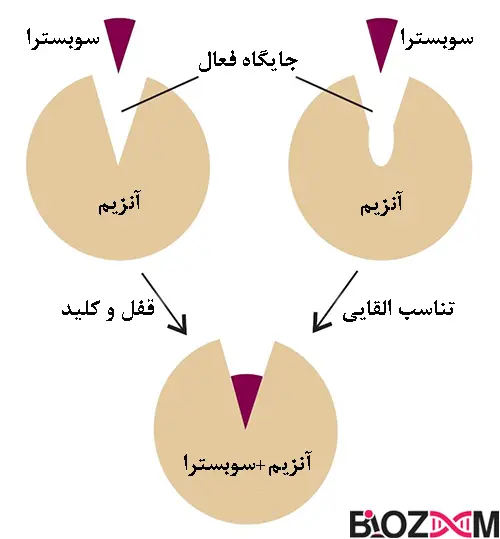
مدل قفل و کلید
با توجه به مدل قفل و کلید، جایگاه فعال آنزیم دارای کانفورماسیون (Conformation) خاصی است که دقیقاً سوبسترا را تکمیل میکند به طوری که سوبسترا با یک جایگاه خاص به روشی شبیه به قفل و کلید مطابقت دارد.
این مدل توضیح میدهد که چگونه آنزیمها اختصاصیت ویژهای را برای یک سوبسترا خاص نشان میدهند. اشکال این مدل این است که نمیتواند ثبات حالت گذار را که آنزیمها به دست میآورند توضیح دهد.
مدل تناسب القایی
با توجه به مدل تناسب القایی، جایگاه فعال یک آنزیم برای سوبسترا مناسب نیست. در عوض، زمانی که در معرض یک سوبسترا قرار میگیرد، جایگاه فعال برای بهبود اتصال دستخوش تغییرات ساختاری میشود.
این مدل توضیح بهتری در مورد اینکه چگونه آنزیمها ممکن است ویژگی اختصاصیت از خود نشان دهند ارائه میدهد. بهعنوان مثال، توضیح میدهد که چگونه آنزیم لیپاز قادر است به انواع لیپیدها متصل شود.
مدل تناسب القایی همچنین توضیح بهتری از چگونگی کاتالیزور ارائه میدهد. بر اساس این نظریه، پیوندها در سوبسترا به دلیل تغییرات ساختاری تحتفشار قرار گرفته که باعث افزایش واکنشپذیری میشود.
جمعبندی
همانطور که اشاره شد، آنزیمها کاتالیزورهای زیستی هستند که باعث تسریع واکنشهای شیمیایی در بدن شده ولی خود در طی واکنش مصرف نمیشوند. آنزیمها اغلب از جنس پروتئین هستند؛ ولی تعدادی نیز از RNA ساخته شدهاند. علاوه بر این آنزیمها امروزه در طیف وسیعی از حیطههای صنعتی و پزشکی مورد استفاده قرار میگیرند؛ بنابراین شناخت بیوشیمی آنزیم ها هم از جهت برطرفکردن مشکلات به وجود آمده در اثر عملکرد نادرست آنها در بدن، و هم از جهت تسهیل واکنشهای شیمیایی در بدن دارای اهمیت است.